
| V |
| 22.4L/mol |
| n |
| V |
| 22.4L |
| 22.4L/mol |
| 1mol |
| 0.2L |
| 0.5mol/L×0.3L |
| 1.5mol/L |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、酸性KMnO4溶液中通入SO2气体后紫色消失 |
| B、显红色的酚酞溶液通入SO2气体后红色消失 |
| C、氯化铁溶液中通入SO2气体后溶液变色 |
| D、溴水通入SO2气体后橙色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何条件下,等物质的量的甲烷和一氧化碳所含的原子数一定相等 |
| B、同温同压下,相同体积的物质,其物质的量一定相等 |
| C、1L甲烷气体一定比1L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、过氧化钠的电子式: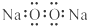 | ||
B、质子数为35、中子数为45的溴原子:
| ||
C、硫离子的结构示意图: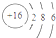 | ||
| D、乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的Na2CO3溶液中,阴离子的总数目大于0.1NA |
| B、常温下,46 g NO2和N2O4混合气体中含有的分子总数为2NA |
| C、标准状况下,22.4L的HF含有NA个分子 |
| D、标准状况下,10g的庚烷分子中含有2.2NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com