
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ | ⑩ |
分析 由元素在周期表的位置可知,①~⑩分别为C、O、Al、Si、S、Cl、Ar、K、Ca、Se,
(1)同周期从左向右金属性减弱,同主族从上到下金属性增强;
(2)①~⑩元素中,最高价氧化物对应的水化物中,氢氧化铝具有两性,与NaOH反应生成偏铝酸钠和水;
(3)①~⑩元素中,最高价氧化物对应的水化物中高氯酸的酸性最强,KOH的碱性最强;
(4)具有相同电子层结构的离子中,原子序数大的离子半径小.
解答 解:由元素在周期表的位置可知,①~⑩分别为C、O、Al、Si、S、Cl、Ar、K、Ca、Se,
(1)同周期从左向右金属性减弱,同主族从上到下金属性增强,则①~⑩元素中,金属性最强的是K,故答案为:K;
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是Al,该最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是HClO4,碱性最强的是KOH,故答案为:HClO4;KOH;
(4)具有相同电子层结构的离子中,原子序数大的离子半径小,则⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是S2->Cl->K+>Ca2+,
故答案为:S2->Cl->K+>Ca2+.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液 | |
| B. | 配制100g20%的硝酸钾溶液,不需要用到容量瓶 | |
| C. | 可以用酒精萃取的方法将溴从溴水中提取出来 | |
| D. | 焰色反应实验前,应先用稀硫酸洗净铂丝,再在酒精灯上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
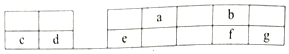
| A. | a、b、f三种元素的最高价含氧酸均是强酸 | |
| B. | c、d、e三元素的最高价的水化物均是强碱 | |
| C. | a、b、f、g四种元素的氢化物的热稳定性逐渐增强 | |
| D. | e元素的单质既能与氢氧化钠溶液反应,又能与稀硫酸反应且均有氢气放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
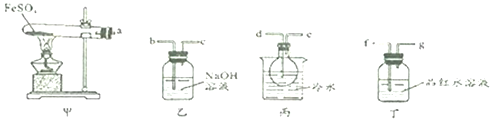
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 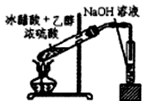 实验室中常用图的原理制取少量的乙酸乙酯* | |
| B. | 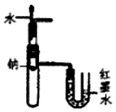 图所示装置及现象验证了Na和水的反应是放热反应 | |
| C. | 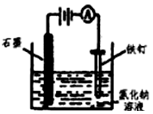 利用图所示装置原理可以防止铁钉生锈 | |
| D. | 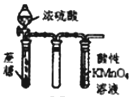 图中酸性KMnO4溶液颜色逐渐变浅可证明浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | 常温下0.1mol/L的Na2A溶液pH=10,该溶液中水电离的c(OH-)=10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用还原性较强的物质做为负极,负极向外提供电子:用氧化性较强的物质作为正极,正极从外电路得到电子 | |
| B. | 盐桥中的K+会移向ZnSO4溶液,Cl-移向CuSO4溶液,使两个半电池保持中性 | |
| C. | 盐桥的引入,解决了Zn直接与CuSO4溶液反应降低原电池工作效率的问题 | |
| D. | 放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com