
 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C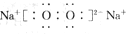
分析 (1)若D是具有氧化性的单质,A为主族的金属,钠与氧气的反应符合转化关系,即A为Na,B为Na2O,D为O2,C为Na2O2;
(2)若A是某物质的稀溶液,D是金属.说明金属具有变价,稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3 →Fe(NO3)2,所以A为Cl2、D为Fe,、B为FeCl2、C为FeCl2,据此解答;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,应含有Al元素,可推知A为偏铝酸盐、D为强酸、B为氢氧化铝、C为铝盐(或者A为铝盐、D为强碱、B为氢氧化铝、C为偏铝酸盐).
解答 解:(1)若D是具有氧化性的单质,A为主族的金属,则A为Na,B为Na2O,D为O2,C为Na2O2,C的电子式为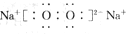 ,
,
故答案为:Na;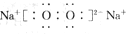 ;
;
(2)若D是金属,由转化关系可知,D为变价金属,A具有强氧化性,可推知A为氯气、D为Fe,、B为FeCl2、C为FeCl2,则:FeCl2溶液在储存时应加入少量Fe,其理由是:加入少量铁,发生反应2Fe3++Fe=3Fe2+,防止Fe2+被氧化为Fe3+,Fe在潮湿的空气中易发生吸氧腐蚀,原电池正极的电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:加入少量铁,发生反应2Fe3++Fe=3Fe2+,防止Fe2+被氧化为Fe3+;O2+2H2O+4e-=4OH-;
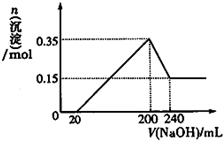
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,应含有Al元素,可推知A为偏铝酸盐、D为强酸、B为氢氧化铝、C为铝盐(或者A为铝盐、D为强碱、B为氢氧化铝、C为偏铝酸盐),则:B转化为C的所有可能的离子方程式为:Al(OH)3+3H+=Al3++3H2O 或Al(OH)3+OH-=AlO2-+2H2O;化合物Al(OH)3经过一系列反应可以得到单质E为Al,将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体,待反应完全后,向所得溶液中加入NaOH溶液,由图可知,200~240mL为氢氧化铝与氢氧化钠反应,可知n[Mg(OH)2]=0.15mol,根据Mg元素守恒可知:m(Mg)=0.15mol×24g/mol=3.6g,沉淀最大时为氢氧化镁、氢氧化铝,故n[Al(OH)3]=0.35mol-0.15mol=0.2mol,根据电荷守恒可知,20~200mL消耗氢氧化钠的物质的量等金属提供电子物质的量,故n(NaOH)=0.15mol×2+0.2mol×3=0.9mol,则c(NaOH)=$\frac{0.9mol}{0.2L-0.02L}$=5mol/L,n(H2SO4)=$\frac{1}{2}$×5mol/L×0.2L=0.5mol,所以c(H2SO4)=$\frac{05mol}{0.5L}$=1mol/L,
故答案为:Al(OH)3+3H+=Al3++3H2O 或Al(OH)3+OH-=AlO2-+2H2O;3.6g;5mol/L;1mol/L.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,(3)中计算关键清楚个阶段发生的反应,注意利用守恒思想解答,难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氢氧化钠、干冰 | B. | 澄清石灰水、铜、氨气 | ||
| C. | 石油、水、硫酸钡 | D. | 海水、氯化钠、氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减少 | C. | V1增大,V2减小 | D. | V1减小,V2增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OF2(F显正价) | B. | CN-(N显正价) | C. | NH2-(H显正价) | D. | SiC (C显正价) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有阴离子的化合物中一定含有阳离子 | |
| B. | 非金属元素组成的化合物一定是共价化合物 | |
| C. | 干冰升华时,分子内共价键会发生断裂 | |
| D. | 两种元素组成的分子中一定只有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A元素位于元素周期表的第三周期ⅢA族 | |
| B. | B的单质只能与硫酸反应,不能与氢氧化钠溶液反应 | |
| C. | C的气态氢化物的沸点比D的气态氢化物的沸点高 | |
| D. | D的非金属性比C的非金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com