
����Ŀ����1��ʵ������ȡ��Ȳ�Ļ�ѧ����ʽΪ_________________,���������Ȳʱ��Ҫ��________��Һ���ѧʽ������_________��Һ��ȥ��������H2S��PH3��ʵ������ȡ��ϩ�������ʱ������ˮ�����Ը�����ؼ�����ϩʱ����Ҫ��ȥ________��д��ѧʽ����ͬ���ĸ��ţ������鷢����ȥ��Ӧʱ�����Ը��������Һ�������ʱ�Ƿ���Ҫ���ӣ������ԭ��_________________________________________��
��2��������¹����γɵķ�ɢϵ���з��ࣺ�ٻ����ͼ��뵽ˮ�к��ֽ��裻��������ˮ�м����������ǡ�ñ��ͣ��۱����Ȼ�����Һ����μ�����������������Һ��������������Һ��ͨ�������CO2��������ֽ�����������������õ�����Һ�� �����ײ��Ϸ�ɢ���������Ʊ����ϲ��ϣ��ߵ�ˮ�;ƾ��Ļ������ڽ������____________��һ��ͨ��_______________��������塣
��3��ȡ2.08gijNaHSO3��Ħ������Ϊ104g/mol����Ʒ������ˮ����ת�Ƶ�100mL����ƿ�У�������ˮ���ݣ�ȡ��5mL������0.01mol/L KMnO4������Һ�ζ�������ΪMn2+������ȥ10.00mL��д���ζ������з�����Ӧ�����ӷ���ʽ____________������Ʒ�Ĵ���Ϊ_______
��4��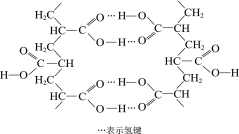 ������Ľṹ��ʽΪ__________________
������Ľṹ��ʽΪ__________________
���𰸡�CaC2 +2 H2O![]() Ca(OH)2 +
Ca(OH)2 +![]() �� Br2������KMnO4 ����ͭ SO2 ��Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ�� �ݢ� �����
�� Br2������KMnO4 ����ͭ SO2 ��Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ�� �ݢ� ����� ![]() 25% CH2=CHCOOH
25% CH2=CHCOOH
��������
��ʵ������ȡ��Ȳ�Ļ�ѧ����ʽΪCaC2 +2 H2O![]() Ca(OH)2 +
Ca(OH)2 +![]() �������������Ȳʱ��Ҫ����ˮ�����Ը��������Һ��������ͭ��Һ��ȥ��������H2S��PH3��ʵ������ȡ��ϩ�������ʱ������ˮ�����Ը�����ؼ�����ϩʱ����Ҫ��ȥSO2�ĸ��ţ������鷢����ȥ��Ӧʱ�����Ը��������Һ�������ʱ��Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ��
�������������Ȳʱ��Ҫ����ˮ�����Ը��������Һ��������ͭ��Һ��ȥ��������H2S��PH3��ʵ������ȡ��ϩ�������ʱ������ˮ�����Ը�����ؼ�����ϩʱ����Ҫ��ȥSO2�ĸ��ţ������鷢����ȥ��Ӧʱ�����Ը��������Һ�������ʱ��Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ��
�ʴ�Ϊ��CaC2 +2 H2O![]() Ca(OH)2 +
Ca(OH)2 +![]() ����Br2������KMnO4������ͭ��SO2����Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ��
����Br2������KMnO4������ͭ��SO2����Ҫ���ӣ�ԭ�����������������ƴ���Һ�з�����ȥ��Ӧ����ϩ���������Ҵ������߶�Ҫ�����Ը��������Һ����������ԭ��Ӧ��
�Ƣٻ����ͼ��뵽ˮ�к��ֽ��裬�γ�����Һ�����ú����߷ֲ㲻���ܣ�
��������ˮ�м����������ǡ�ñ��ͣ��γ���Һ��
�۱����Ȼ�����Һ����μ�����������������Һ���γɳ�����
������������Һ��ͨ�������CO2���γɳ������������ܽ��Ϊ��Һ��
������ֽ�����������������õ�����Һ�����������ֽ����Ȼ�ǽ��壻
�����ײ��Ϸ�ɢ���������Ʊ����ϲ��ϣ����Ͻ������������ڽ��壻
�ߵ�ˮ�;ƾ��Ļ�������Һ��
���ڽ�����Ǣݢޣ�һ��ͨ���������������塣
�ʴ�Ϊ���ݢޣ��������
��NaHSO3��KMnO4������Һ��Ӧ��KMnO4����ԭΪMn2+����HSO3-������ΪSO42-��������Ӧ�����ӷ���ʽΪ![]() ��
��
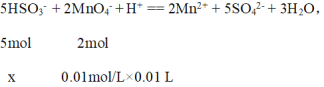
����õ�x = 2.5��10-4 mol��
����Ʒ�Ĵ���Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��25%��
��25%��
��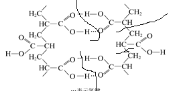 ��ͨ������������Ľṹ��ʽΪCH2=CHCOOH��
��ͨ������������Ľṹ��ʽΪCH2=CHCOOH��
�ʴ�ΪCH2=CHCOOH��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�ʵ���װ�á�ҩƷ�������������Ԥ���ж���ȷ����( )��
A. 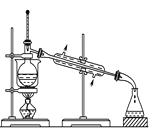 �ɴӺ���ı���Һ�������ⵥ�ʲ����ձ��ܼ�
�ɴӺ���ı���Һ�������ⵥ�ʲ����ձ��ܼ�
B. 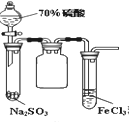 ��70%H2SO4��Na2SO3��ĩ��Ϻɹ۲쵽�Ҷ��Թ��ڳ��ֵ���ɫ����
��70%H2SO4��Na2SO3��ĩ��Ϻɹ۲쵽�Ҷ��Թ��ڳ��ֵ���ɫ����
C. 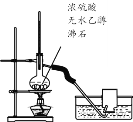 ������ƿ��Һ��Ѹ��������170��ʱ��������ˮ���ռ�����ϩ����
������ƿ��Һ��Ѹ��������170��ʱ��������ˮ���ռ�����ϩ����
D. 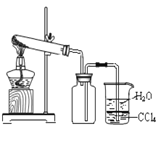 ��ʢ�Ȼ�狀���ʯ�ҹ�����Թܼ��ȣ�����ȡ���ռ��������NH3
��ʢ�Ȼ�狀���ʯ�ҹ�����Թܼ��ȣ�����ȡ���ռ��������NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ�ΪAl(OH)2Cl����Ҫ��������Ƥ���������(��Ҫ�ɷ�ΪAl��Al2O3��AlN��FeO��)�Ʊ���������һ�ֹ�����ͼ��ʾ��
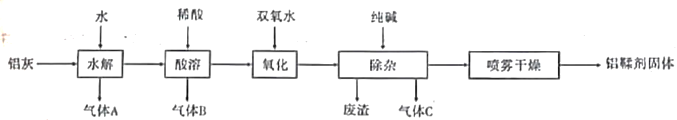
��ش��������⣺
��1������A������C�ķ���ʽΪ_________��______________
��2����������B�Ļ�ѧ����ʽΪ��________________________________________________
��3������ʱ��������Ӧ�����ӷ���ʽΪ��__________________________________________
��4����������Ҫ�ɷ�Ϊ__________________(�ѧʽ)��
��5��ijͬѧ������·����ⶨ��������Ʒ��Al(OH)2Cl����������
������ȷ��ȡ���Ʊ���������m g�����ձ��С�
��������_____________(���Լ�����)�����ò���������������ȫ���ܽ⡣
������������___________(�ѧʽ)��Һ����ַ�Ӧ�����ˡ�_________��__________�ù���n g�������������ݼ��ɼ������Ʒ��Al(OH)2Cl����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������ȷ����
A. ���Ƶ�ˮ�ⷴӦ��S2-+H3O��![]() HS-+H2O
HS-+H2O
B. ��ͭ����������Ȼ�ͭ��Һ��Cu2��+2Cl-![]() Cu+Cl2��
Cu+Cl2��
C. Na2CO3��Һ�ʼ��Ե�ԭ��CO32-+H2O![]() HCO3��+OH��
HCO3��+OH��
D. ��Ba(OH)2��Һ�еμ�KHSO4��Һ��pH=7��Ba2��+OH��+H��+SO42-=BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�±����AgX(X��Cl����Br����I��)��Ag2CrO4�ij����ܽ�ƽ��������ͼ��ʾ��������p(Ag��)��ʾ����lgc(Ag��)����������Y��ʾ����lgc(X��)����lgc(CrO42��)��������˵����ȷ����
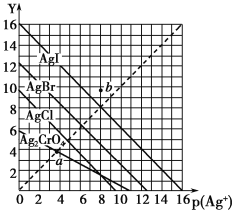
A. a���ʾc(Ag��)��c(CrO42��)
B. b��ɱ�ʾAgI�ı�����Һ
C. ���¶���AgI��KspԼΪ1��10��16
D. ���¶���AgCl��AgBr������Һ�У�c(Cl��)<c(Br��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
(1)NH4Al(SO4)2������ˮ������ԭ����__________________________________________(�ñ�Ҫ�Ļ�ѧ������������˵��)��
(2)��ͬ�����£�0.1 mol��L��1��NH4Al(SO4)2��Һ��0.1 mol��L��1NH4HSO4��Һ�е�c(![]() )��ǰ��_____���ߡ�(����ڡ��������ڡ���С�ڡ�)
)��ǰ��_____���ߡ�(����ڡ��������ڡ���С�ڡ�)
(3)��Ϊ0.1 mol��L��1�ļ��ֵ������Һ��pH���¶ȱ仯��������ͼ��ʾ��
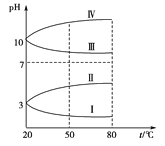
�����з���0.1 mol��L��1NH4Al(SO4)2��pH���¶ȱ仯��������_______ (����ĸ)������pH���¶ȱ仯��ԭ����__________________��
��20 ��ʱ��0.1 mol��L��1��NH4Al(SO4)2��2c(SO42��)��c(NH4+)��3c(Al3��)��____________��
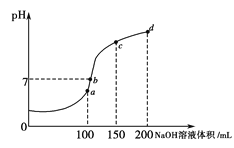
(4)����ʱ����100 mL 0.1 mol��L��1NH4HSO4��Һ�еμ�0.1 mol��L��1NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ���Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������___________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����ڼӳɷ�Ӧ����( )
A. CH3Cl+Cl2 �� CH2Cl2 + HCl
B. CH2=CH2+HO��H �� HOCH2��CH3
C. 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
D. ![]() +Br2
+Br2![]()
![]() + HBr
+ HBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ������ƿ������Һʱ�����ڲ��������������������������ʹ������ҺŨ��ƫ�͵��ǣ� ��
������ƽ(ʹ������)����ʱ�����������������λ�÷ŵߵ�
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ��
��ת����Һǰ����ƿ������������ˮ
�ܶ���ʱ����������ƿ�Ŀ̶���
�ݶ��ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶���
A. �٢ڢ�B. �٢ۢ�C. �ۢܢ�D. �ڢۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com