
下列有关电解原理的说法正确的是( )
①电解是把电能转变成化学能;
②电解是把化学能转变为电能;
③电解质溶液的导电是化学变化,金属的导电是物理变化;
④不能自发进行的氧化还原反应,通过电解原理可以实现;
⑤任何溶液被电解时必然会导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
科目:高中化学 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是____________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸
d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+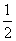 S2(g)
S2(g)
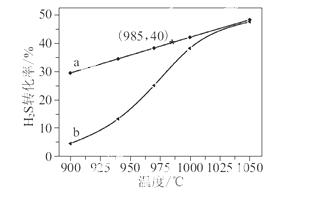
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算 985 ℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:_______________________________。
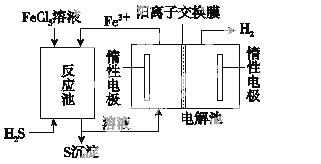
②电化学法
该法制氢过程的示意图如图所示。反应池中反应物的流向采用气、液逆流方式,其目的是
________________________________________________________________________;
反应池中发生反应的化学方程式为_____________________________________________
________________________________________________________________________。
反应后的溶液进入电解池,电解总反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O +2I-===2SO
+2I-===2SO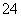 +I2 (慢)
+I2 (慢)
I2+2S2O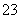 ===2I-+S4O
===2I-+S4O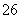 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O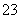 与S2O
与S2O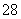 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O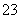 )∶n(S2O
)∶n(S2O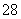 )__________。
)__________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________, 理由是___________________________________。
理由是___________________________________。
(3)已知某条件下,浓度c(S2O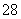 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O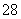 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。

(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________;碘电极作为该电池的________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸的第一步电离(H2SO4 = H++HSO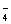 )是完全的,但第二步电离(HSO
)是完全的,但第二步电离(HSO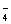
 H+ + SO
H+ + SO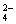 )并不完全。如果25℃时,01 mol·L-1 H2SO4溶液中c(SO
)并不完全。如果25℃时,01 mol·L-1 H2SO4溶液中c(SO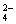 ) = 0.010 mol·L-1,01 mol·L-1 NaHSO4溶液中c(SO
) = 0.010 mol·L-1,01 mol·L-1 NaHSO4溶液中c(SO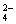 ) = 0.029 mol·L-1,试回答:
) = 0.029 mol·L-1,试回答:
(1)25℃时,01 mol·L-1 H2SO4溶液中pH = ;(可用对数表示)
(2)为何01 mol·L-1 的H2SO4 溶液中的c(SO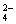 )比01 mol·L-1 的NaHSO4 溶液中c(SO
)比01 mol·L-1 的NaHSO4 溶液中c(SO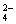 ) 小?
) 小?
(3)0.1 mol·L-1 Na2SO4溶液的pH值 7(填大于、小于或等于)
(4)固体NaHSO4与固体食盐混和共热至600℃,能否得到HCl气体?为什么?
(5)常温下测得0.25 mol·L-1的CuSO4溶液的pH值为5,025 mol·L-1 Cu(ClO4)2溶液的pH值为45,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,气体的密度与它的摩尔质量成正比.一只气球若放在空气(空气平均摩尔质量为29g/mol)中可静止不动,那么在相同条件下该气球放在下列气体中会下沉的是( )
|
| A. | O2 | B. | Cl2 | C. | CO2 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释(或结论)都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
|
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后PH>7,则c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) |
|
| B. | 已知MgCO3的Ksp=6.82×10﹣6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32﹣),且C(Mg2+)•C(CO32﹣)═6.82×10﹣6 mol•L﹣1 |
|
| C. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) |
|
| D. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com