
分析 (1)①根据化合价代数和为0计算Fe的化合价;
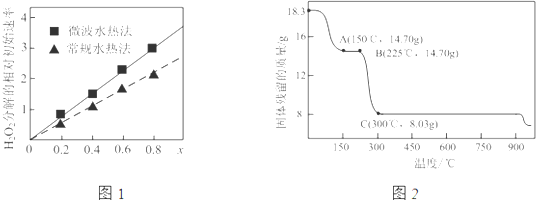
②过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大;
(2)CoCl2溶液中滴加NaOH溶液Co(OH)2沉淀和NaCl,Co(OH)2与氧气和水反应生成Co(OH)3,Co(OH)3与HCl反应生成氯气、CoCl2和水;
(3)①由图可知,CoC2O4•2H2O的质量为18.3g,其物质的量为0.1mol,根据B点固体的质量分析;
CoC2O4•2H2O的质量为18.3g,其中Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,根据两种元素的物质的量之比计算;
②由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),然后计算钴氧化物中n(Co2+):n(Co3+).
解答 解:(1)①CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为$\frac{4×2-(2x+2-2x)}{2}$=+3,故答案为:+3;
②过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;
由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,即钴、镍比越大,催化剂的催化活性越高,
故答案为:微波水热;钴、镍比越大,催化剂的催化活性越高;
(2)CoCl2溶液中滴加NaOH溶液Co(OH)2沉淀和NaCl,Co(OH)2与氧气和水反应生成Co(OH)3,Co(OH)3与HCl反应生成氯气、CoCl2和水,发生的反应方程式为:CoCl2+2NaOH=Co(OH)2↓+2NaCl、4Co(OH)2+O2+2H2O=4Co(OH)3、2Co(OH)3+6HCl=2CoCl2+Cl2↑+3H2O;
故答案为:CoCl2+2NaOH=Co(OH)2↓+2NaCl;4Co(OH)2+O2+2H2O=4Co(OH)3;2Co(OH)3+6HCl=2CoCl2+Cl2↑+3H2O;
(3)①由图可知,CoC2O4•2H2O的质量为18.3g,其物质的量为0.1mol,已知CoC2O4的式量为147,则0.1molCoC2O4的质量为14.7g,则B点为CoC2O4;
CoC2O4•2H2O物质的量为0.1mol,则其中Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C点Co的氧化物为Co3O4;
故答案为:CoC2O4、Co3O4;
②由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,
由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×$\frac{4.48L}{22.4L/mol}$)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
则钴氧化物中n(Co2+):n(Co3+)=0.64:0.4=3:2;
故答案为:3:2.
点评 本题考查元素化合价的判断、物质化学式的计算、得失电子守恒规律的应用、对图象的分析处理等,注意利用电子守恒和原子守恒计算,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
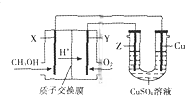 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )| A. | Y为燃料电池的正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 此电解过程中,Z电极上的反应始终为:2H2O-4e-═4H++O2↑ | |
| C. | 电解过程中中铜电极不会被溶解,其原理为牺牲阳极的阴极保护法 | |
| D. | 电子沿着X→Cu→Z→Y路径移动,每个电极均通过0.6mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
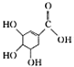 )和鞣酸(
)和鞣酸(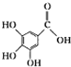 )的叙述中,正确的是( )
)的叙述中,正确的是( )| A. | 两种有机物中含有完全相同的官能团 | |
| B. | 两种酸都能与溴水反应,且反应类型相同 | |
| C. | 分别向两种酸中滴加三氯化铁溶液,均发生显色反应 | |
| D. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 检验溶液中的Fe2+离子 | 向溶液中先加入KSCN溶液,再加入氯水 |
| B | 除去Na2SO4溶液中的Na2SO3 | 向混合液中加入适量稀盐酸 |
| C | 用豆浆做豆腐 | 向煮沸的豆浆中加入盐卤(含NaCl、MgCl2、CaCl2等)溶液 |
| D | 排除SO42-对Cl-检验的干扰 | 向混合液中加入过量的Ba(NO3)2溶液,过滤后再取滤液进行检验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将镁块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 推广使用新能源,可以减少二氧化碳等温室气体的排放 | |
| C. | 焊锡中加铅的目的是降低熔点 | |
| D. | 石油是混合物,其分馏产品汽油为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气是未来的理想燃料 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 人体缺铁易引起甲状腺肿大 | D. | 乙醇是不可再生的生物质能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2+Br2$\stackrel{CCI_{4}}{→}$CH3CHBrCH2Br | |
| B. | CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CH2+H2O | |
| C. | CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| D. | C6H6+HNO3$→_{△}^{浓H_{2}SO_{4}}$C6H5NO2+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com