
| A.玻璃钢是由普通玻璃加强热然后骤冷而得到的,所以其成分与普通玻璃相同 |
| B.玻璃钢是以玻璃为基体,钢纤维做增强体的复合材料 |
| C.玻璃钢的基体是合成树脂,增强体是玻璃纤维 |
| D.玻璃的强度和机械加工性能比合金钢稍差,但耐腐蚀性和绝缘性比合金钢好 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

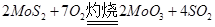 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
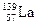 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为: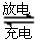 LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
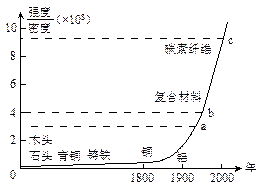
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
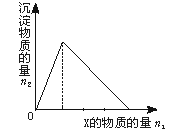
| | A | B | C | D |
| X | NaOH | AlCl3 | HCl | Na[Al (OH)4] |
| Y | AlCl3 | NaOH | Na[Al (OH)4] | HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
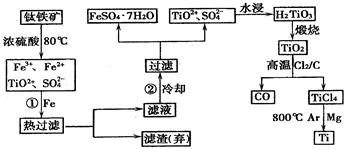
 2MgCl2+Ti , 在Ar气体中进行的目的是
2MgCl2+Ti , 在Ar气体中进行的目的是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Si可用来制造半导体材料 |
| B.SiO2可用于制造光导纤维 |
| C.合金中可以含有非金属元素 |
| D.铝合金比纯铝的硬度低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com