
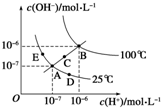
| A. | 图中五点Kw的关系:B>C>A=D=E | |
| B. | 若从A 点到D 点,可采用:温度不变向水中加入少量的酸 | |
| C. | 若从A 点到C 点,可采用:温度不变向水中加入适量的NH4Cl 固体 | |
| D. | 若处在B 点时,将pH=2 的硫酸与pH=10 的KOH 溶液等体积混合后,溶液显中性 |
分析 A.水的电离吸热,则温度越高,Kw越大,相同曲线上Kw相同;
B.从A 点到D 点,Kw不变,c(H+)增大;
C.从A 点到C 点,Kw增大;
D.B 点时,Kw=10-12,pH=2 的硫酸与pH=10 的KOH 溶液等体积混合后,n(H+)=n(OH-).
解答 解:A.水的电离吸热,则温度越高,Kw越大,相同曲线上Kw相同,则图中五点Kw的关系:B>C>A=D=E,故A正确;
B.从A 点到D 点,Kw不变,c(H+)增大,则可采用温度不变向水中加入少量的酸的方法实现,故B正确;
C.从A 点到C 点,Kw增大,则需要升高温度,故C错误;
D.B 点时,Kw=10-12,pH=2 的硫酸中c(H+)=0.01mol/L,与pH=10 的KOH 溶液c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-10}}$=0.01mol/L,等体积混合后,n(H+)=n(OH-),溶液为中性,故D正确;
故选C.
点评 本题考查酸碱混合及水的电离平衡,为高频考点,把握图中Kw的关系、pH的计算、酸碱混合及平衡移动等为解答的关键,侧重分析与应用能力的考查,注意选项C中Kw变大,题目难度不大.


科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:
(1)配平该反应的离子方程式,并在 中填上所需的微粒。
中填上所需的微粒。
H++ MnO4- + H2C2O4= CO2↑+ Mn2++ 
(2)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为 mol。
(3)测定血钙的含量的方法:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 ____________________。
②溶解沉淀时 (“能”或“不能”)用稀盐酸,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁制品,镀层破损后铁制品将彻底失去保护 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 草木灰与铵态氮肥混合施用效果更好 | |
| D. | Na2CO3可做食用碱,NH4Cl溶液可去除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式: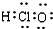 | B. | 中子数为10的氧原子:${\;}_{8}^{18}$O | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CH4分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | b电极的反应为:2H2O-4e-═O2↑+4H+ | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Mg2+、NO3-、CO32- | B. | Na+、Ag+、Cl-、Ba2+ | ||
| C. | K+、Ba2+、Cl-、HCO3- | D. | Ba2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
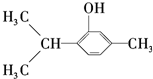 )用于制香料、药物和指示剂等,下列说法正确的是( )
)用于制香料、药物和指示剂等,下列说法正确的是( )| A. | 百里酚的分子式为C10H16O | |
| B. | 百里酚可与氯化铁发生显色反应 | |
| C. | 百里酚分子中所有碳原子可以在同一平面上 | |
| D. | 百里酚既可与盐酸反应,又可与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
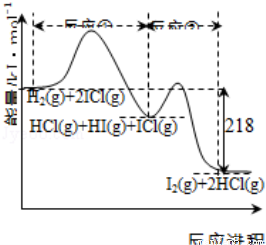
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为△H=﹣218kJ•mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com