
|
| 1 |
| 45 |
| 1 |
| 45 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、0.3mol/L |
| B、0.15mol/L |
| C、0.2mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
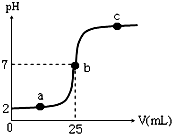 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
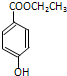 ).
).
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
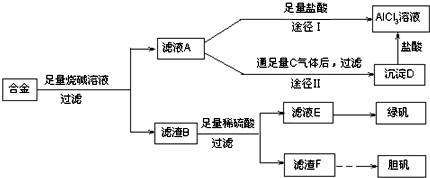
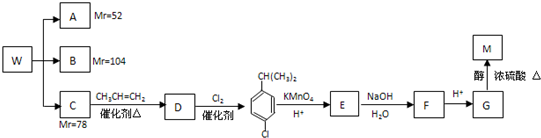
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com