
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
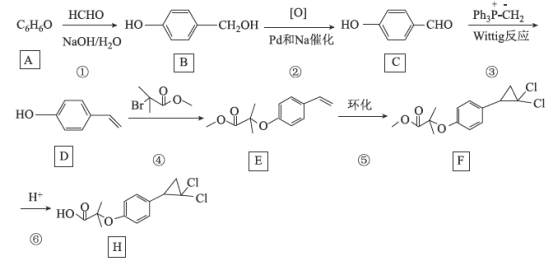
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
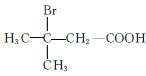
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
【答案】对羟基苯甲醛(或4-羟基苯甲醛) 酯基、醚键 C13H14O3Cl2 加成反应 ![]() +
+![]() →
→![]() +HBr 12
+HBr 12 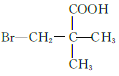 、
、
【解析】
A(![]() )与HCHO在碱性条件下发生加成反应生成B(
)与HCHO在碱性条件下发生加成反应生成B(![]() );B氧化生成C(
);B氧化生成C(![]() );C生成D(
);C生成D(![]() );D与
);D与![]() 发生取代反应生成E(
发生取代反应生成E(![]() )和HBr;E环化生成F(
)和HBr;E环化生成F(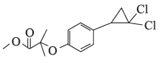 );F酸性条件下水解生成H(
);F酸性条件下水解生成H(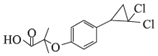 ),据此分析。
),据此分析。
(1)C为![]() ,命名为对羟基苯甲醛(或4-羟基苯甲醛);
,命名为对羟基苯甲醛(或4-羟基苯甲醛);
答案:对羟基苯甲醛(或4-羟基苯甲醛)
(2)F为 ,F中含氧官能团为酯基、醚键;
,F中含氧官能团为酯基、醚键;
答案:酯基、醚键
(3)H为 ,由结构简式可知,H的分子式为C13H14O3Cl2;
,由结构简式可知,H的分子式为C13H14O3Cl2;
答案:C13H14O3Cl2
(4)反应①为加成反应,反应④为取代反应,产物中还有HBr,化学方程式为![]() +
+![]() →
→![]() +HBr;
+HBr;
答案:加成反应 ![]() +
+![]() →
→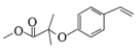 +HBr
+HBr
(5)M为![]() 的同分异构体,满足条件的M的结构简式为
的同分异构体,满足条件的M的结构简式为 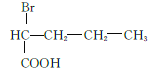 、
、 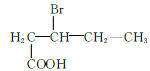 、
、 、
、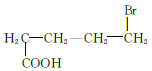 、
、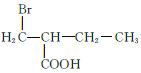 、
、 、
、 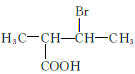 、
、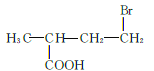 、
、 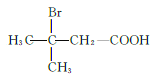 、
、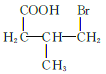 、
、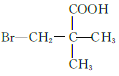 、
、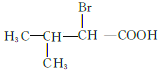 共12种;其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为
共12种;其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为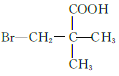 、
、 ;
;
答案:12种 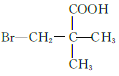 、
、
(6)根据题干信息①②③可得出合成路线,由环己烷为原料制备![]() 的合成路线为
的合成路线为 ;
;
答案:


科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: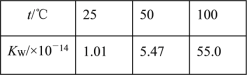
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )
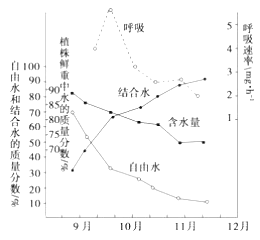
A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)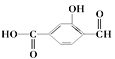 具有官能团分别为:羧基、_______和________(填名称),
具有官能团分别为:羧基、_______和________(填名称),
(2)苯酚与溴水生成白色沉淀,发生__________反应;乙烯通入溴水,发生_______反应。(填“加成”或者“取代”)
(3)以下几组:①白磷和红磷 ②D和T
③异丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互为同系物的是____________;互为同分异构体的是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
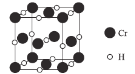
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列6种符号回答问题:①1H ②2H ③3H ④14C ⑤14N ⑥16O
(1)共有________种核素,属于________种元素。
(2)互为同位素的是___________。(填序号,下同)
(3)中子数相等的是________________。
Ⅱ.有下列物质:①CO2 ②KCl ③氮气 ④H2⑤NH4Cl ⑥NaOH ⑦H2SO4试用以上编号填空:
(1)只有非极性键的是______________;
(2)只有极性键的是__________________;
(3)只有离子键的是___________________;
(4)既有离子键,又有极性键的是___________________;
(5)属于共价化合物的是___________________。
Ⅲ.写出下列物质的电子式
(1)N2__________;HClO_________;MgCl2___________;NaOH___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是( )
A.H2Y的电离方程式为:![]()
B.在该酸式盐溶液中![]()
C.HY-的水解方程式为![]()
D.在该酸式盐溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2 析出,依据I2 析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝的时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
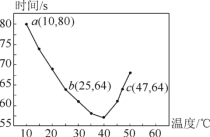
A. 40℃之前与40℃之后溶液变蓝时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3的平均反应速率一定相等
C. 图中a点对应的NaHSO3的平均反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵简称硝铵,可用作化肥,含氮量高。它在发生某些反应时既放出大量热又生成大量气体而爆炸,也可作炸药使用。
(1)硝铵受热:NH4NO3→N2O↑+2H2O,该反应中因为有____而属于氧化还原反应,其中发生还原过程元素的变化为___。
(2)硝铵受撞击:2NH4NO3→O2+2N2+4H2O,请在该反应方程式上补齐电子转移的方向和数目___。若反应中转移电子数为3.01×1024,则反应产生的气体在标准状况下的体积为____。
(3)一定温度下,硝铵分解:___NH4NO3→___HNO3+___N2↑+___H2O,配平该反应方程式,把系数填入对应的位置上。反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为___。
(4)硝铵易溶于水,溶解时溶液的温度降低。硝铵溶于水时,温度降低的原因是_____,该水溶液呈(填“酸”“碱”或“中”)____性,用离子方程式表示原因为_____。
(5)为使该水溶液在常温下的pH为7,并不引入杂质,可以_____,试证明所得的溶液中c(NH4+)=c(NO3-):_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com