

分析 (1)双氧水在催化剂的作用下分解产生水和氧气;氯化铁和硫酸铜对双氧水的催化效果明显;
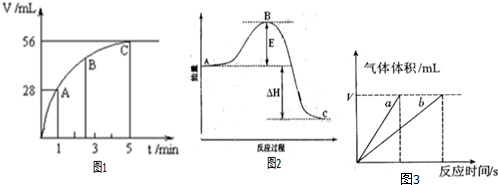
(2)根据斜率大小得出三点速率的大小,根据浓度对反应速率的影响分析;
(3)由图可知,生成氧气为56mL,n(O2)=$\frac{0.056L}{22.4L•mo{l}^{-1}}$=0.0025mol,则n(H2O2)=0.0025mol×2=0.005mol,结合c=$\frac{n}{V}$计算;5分钟的速率由v=$\frac{△c}{△t}$计算;
(4)双氧水的分解是一个放热反应,A表示反应物具有的总能量高,C表示生成物具有的总能量低,催化剂可以降低反应的活化能,但是不影响反应物和生成物的总能量,不影响反应热△H,如图虚线所示是有催化剂时的曲线(虚线代表使用催化剂,起、终点重合),催化剂只加快反应速率,缩短达到平衡所需的时间,不影响氢气的总量,曲线a为有催化剂的曲线.
解答 解:(1)双氧水在催化剂的作用下分解产生水和氧气,用单线桥表示电子转移为: ;双氧水分解反应中还可以用氯化铁或者硫酸铜代替二氧化锰做催化剂加快反应速率,
;双氧水分解反应中还可以用氯化铁或者硫酸铜代替二氧化锰做催化剂加快反应速率,
故答案为: ;氯化铁;硫酸铜;
;氯化铁;硫酸铜;
(2)曲线表示斜率越大,反应速率越快,A、B、C各点所表示的反应速率由小到大的顺序为C<B<A,这是由于随着反应的进行,反应物浓度减小,因此反应速率逐渐减小,
故答案为:C<B<A;随着反应的进行,反应物浓度减小,因此反应速率逐渐减小;
(3)根据图象可知H2O2完全分解后生成氧气的物质的量是n(O2)=$\frac{0.056L}{22.4L•mo{l}^{-1}}$=0.0025mol,则根据方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可知双氧水的物质的量是0.005mol,所以该H2O2水溶液的物质的量浓度为0.005mol÷0.05L=0.1mol•L-1,反应速率为v=$\frac{△c}{△t}$=$\frac{0.1mol•{L}^{-1}}{5min}$=0.02mol/(L•min),
故答案为:0.1mol•L-1;0.02mol/(L•min);
(4)双氧水的分解是一个放热反应,A表示反应物具有的总能量高,C表示生成物具有的总能量低,催化剂可以降低反应的活化能,但是不影响反应物和生成物的总能量,不影响反应热△H,如图虚线所示是有催化剂时的曲线(虚线代表使用催化剂,起、终点重合)
催化剂只加快反应速率,缩短达到平衡所需的时间,不影响氢气的总量,曲线a为有催化剂的曲线,
故答案为: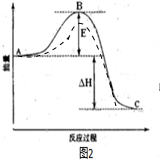 ;反应物的总能量;生成物的总能量;无;a.
;反应物的总能量;生成物的总能量;无;a.
点评 考查过氧化氢分解实验的有关判断和计算、电子转移的表示方法、化学反应与能量的知识,注意图象中斜率与反应速率的关系,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性强弱:H2SO4>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
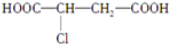 $→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )
$→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )| A. | 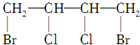 | B. | 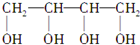 | C. | 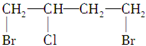 | D. | 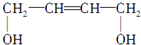 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com