
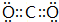 ,故答案为:
,故答案为: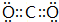 ;
;

科目:高中化学 来源: 题型:
| A、将过量SO2气体通入氨水中:SO2+2NH3+H2O═2NH 4 ++SO32-+H2O |
| B、向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Ee3++I2+4Cl |
| C、向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32- |
| D、硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I═Fe2++5I2+3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| B、用高锰酸钾酸性溶液可区分己烷和3-己烯 |
| C、用水可区分苯和溴苯 |
| D、用金属钠可区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 |
| B、交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 |
| C、乙酸的分子式为CH3COOH,属于弱电解质 |
| D、苯分子中没有碳碳双键,因此苯不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
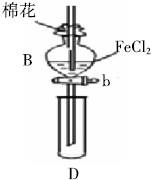 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO42- |
| 乙 | 有Fe3+ 无Fe2+ | 有SO42- |
| 丙 | 有Fe2+ 无Fe3+ | 有Fe2+ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子的最外层电子数相差1.请回答下列问题:
原子的最外层电子数相差1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有些金属晶体比原子晶体熔沸点高 |
| B、晶体只要有阴离子就一定有阳离子 |
| C、原子晶体中一定有非极性共价键 |
| D、分子晶体中不一定有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com