
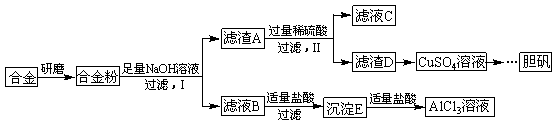
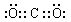 [Al(OH)4]-+CO2=Al(OH)3”ż+HCO3-
[Al(OH)4]-+CO2=Al(OH)3”ż+HCO3- £Ø3£©ÓÉ[Al(OH)4]-ÖĘ×īŗĆ¼ÓČėČõĖį£¬ŅņAl(OH)3²»ČÜÓŚČõĖį£¬¹ŹĶØČėĘųĢåĪŖCO2£¬¹Ź“š°øĪŖ£ŗ
£Ø3£©ÓÉ[Al(OH)4]-ÖĘ×īŗĆ¼ÓČėČõĖį£¬ŅņAl(OH)3²»ČÜÓŚČõĖį£¬¹ŹĶØČėĘųĢåĪŖCO2£¬¹Ź“š°øĪŖ£ŗ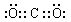 [Al(OH)4]-+CO2 Al(OH)3”ż+HCO3-
[Al(OH)4]-+CO2 Al(OH)3”ż+HCO3- £Ø4£©Cu+H2O2+H2SO4 CuSO4+2H2O
£Ø4£©Cu+H2O2+H2SO4 CuSO4+2H2O

 ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŹ¦Öøµ¼ĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø æŖŠÄĶÜæŚĖćĢāæØĻµĮŠ“š°ø
æŖŠÄĶÜæŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®CsĻŌ£«3¼Ū£¬I”¢Cl¾łĻŌ£1¼Ū |
| B£®CsĻŌ£«1¼Ū£¬ClĻŌ£«1¼Ū£¬IĻŌ£1¼Ū |
| C£®ŌŚCsICl2ČÜŅŗÖŠĶØČėCl2£¬ÓŠµ„ÖŹµāÉś³É |
| D£®ŌŚCsICl2ČÜŅŗÖŠĶØČėSO2ĘųĢ壬ӊĮņĖįÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĀĮ²ŌŚ¾Ę¾«µĘ»šŃęÉĻ¼ÓČČČŪ»Æµ«²»µĪĀ䣬ĖµĆ÷ĀĮ²±ķĆęŃõ»ÆĀĮĤµÄČŪµćøßÓŚĀĮ |
| B£®ĻņĒāŃõ»ÆĢś½ŗĢåÖŠ¼ÓČėÉŁĮæĻ”ĮņĖį£¬Ņņ·¢Éś»Æѧ·“Ó¦¶ų²śÉśŗģŗÖÉ«³Įµķ |
| C£®µē×Ó¹¤ŅµÓĆ30%µÄĀČ»ÆĢśČÜŅŗøÆŹ“·óŌŚÓ”Ė¢ĻßĀ·°åÉĻµÄĶ²£ŗFe3£«£«Cu=Fe2£«£«Cu2£« |
| D£®Fe·Ö±šÓėÉŁĮæĀČĘųŗĶĻ”ŃĪĖį·“Ó¦ĖłµĆĀČ»ÆĪļĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
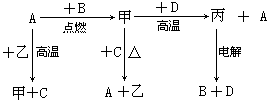
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Fe”śFeCl3 | B£®AlCl3”śAl(OH)3 |
| C£®Fe”śFeCl2 | D£®Na2O”śNaOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĢśŗĶĀČĘų·“Ӧɜ³ÉČż¼ŪĢś£¬ŗĶŃĪĖį·“Ӧɜ³ÉŃĒĢśĄė×Ó |
| B£®ĶŌŚ³±ŹŖµÄæÕĘųÖŠŅ×ÉśŠā³ŹĀĢÉ«£¬ŠāµÄÖ÷ŅŖ³É·ÖŹĒ¼īŹ½Ģ¼ĖįĶ |
| C£®¹żŃõ»ÆÄĘŗĶŃõ»ÆÄĘ¾łæÉŅŌÓėĖ®”¢¶žŃõ»ÆĢ¼·“Ó¦£¬µ«Éś³ÉµÄ²śĪļ²»ĶźČ«ĻąĶ¬ |
| D£®µČÖŹĮæµÄĀĮ·Ö±šÓė×ćĮæµÄĖįŗĶ¼īČÜŅŗ·“Ó¦£¬Éś³ÉĘųĢåµÄĢå»żŅ»¶ØĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| æŖŹ¼³ĮµķŹ± | 1.5 | 3.3 | 6.5 | 9.4 |
| ³ĮµķĶźČ«Ź± | 3.7 | 5.2 | 9.7 | 12.4 |
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)”¤c2(OH-) = 5.6”Į10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)”¤c2(OH-) = 5.6”Į10-12 Ca2+ (aq) + 2OH- (aq) £Ėsp = c(Ca2+)”¤c2(OH-) = 4.7”Į10-6
Ca2+ (aq) + 2OH- (aq) £Ėsp = c(Ca2+)”¤c2(OH-) = 4.7”Į10-6²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| ½šŹō | µē×ÓĮ÷¶Æ·½Ļņ | µēŃ¹/V |
| ¼× | ¼×”śCu | 0.78 |
| ŅŅ | Cu”śŅŅ | 0.15 |
| ±ū | ±ū”śCu | 1.35 |
| ¶” | ¶””śCu | 0.30 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Äʱ£“ęŌŚĆŗÓĶĄļµÄŌŅņÖ®Ņ»ŹĒĖü¼«Ņ×ÓėŃõĘų·“Ó¦ |
| B£®ĀĮŌŚæÕĘųÖŠŗÜČŻŅ×Č¼ÉÕ |
| C£®Ć¾±ķĆęµÄŃõ»ÆĤŹčĖÉ£¬²»Äܱ£»¤ÄŚ²ć½šŹō |
| D£®ĢśŠāµÄÖ÷ŅŖ³É·ÖŹĒFe3O4 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com