
分析 混合发生反应:Na2SO4+BaCl2═BaSO4↓+2NaCl,生成沉淀为硫酸钡,则硫酸钡沉淀的质量=200g+100g-276.7g=23.3g,根据硫酸钡质量计算硫酸钠、生成氯化钠的质量,根据饱和溶液质量分数w=$\frac{s}{s+100}$计算NaCl的溶解度.
解答 解:(1)硫酸钡沉淀的质量=200g+100g-276.7g=23.3g,
设硫酸钠的质量为x,反应生成的氯化钠的质量为y
Na2SO4+BaCl2═BaSO4↓+2NaCl
142 233 117
x 23.3g y
所以x=$\frac{23.3g×142}{233}$=14.2g
y=$\frac{23.3g×117}{233}$=11.7g
(2)滤液中的溶质在该温度下的溶解度s,则$\frac{s}{100g+s}$=$\frac{11.7g+83.7g}{276.7g+83.7g}$,解得s=36g
答:(1)原硫酸钠溶液中溶质的质量为14.2g;
(2)滤液中的溶质在该温度下的溶解度为36g.
点评 本题考查混合物有关计算、溶解度计算,明确发生的反应即可解答,注意对溶解度的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| C. | 青蒿素中含过氧键,过氧键属于极性共价键 | |
| D. | 青蒿素和纤维素都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COONa溶液显碱性 | |
| B. | 0.1mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100mL1mol/L 的CH3COOH溶液需要100mL1mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 122 g•mol-1 | B. | 63 g•mol-1 | C. | 126 g•mol-1 | D. | 163 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主食 | 米饭 | 馒头 | ||
| 副食 | 烧鱼块 | 咸鸡蛋 | 红烧肉 | 花生米 |
| 饮料 | 牛奶 | |||
| 我的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
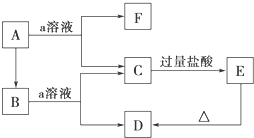
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 第一电离能由小到大的顺序是S<P<Cl | |
| C. | 47Ag原子的价层电子排布式是4d95s2 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
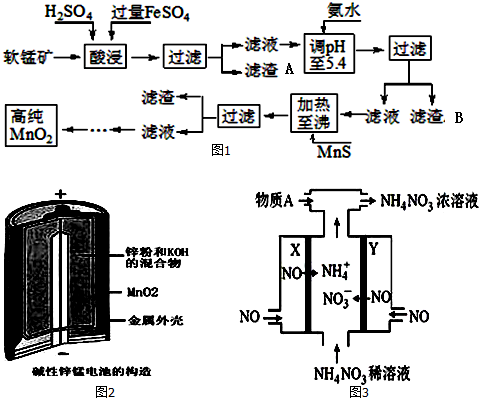
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 温度一定,一个化学反应的平衡常数是一个常数 | |
| B. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度商Qc<Kc,v(正)<v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com