
 目标测试系列答案
目标测试系列答案科目:高中化学 来源:高中化学习题1 题型:013
自来水用氯气消毒沿用已久,因氯气与有机物间的反应会产生某些污染,现正研究用二氧化氯(![]() )代替氯气进行自来水消毒,已证明
)代替氯气进行自来水消毒,已证明![]() 的消毒效果比氯气高,
的消毒效果比氯气高,![]() 的还原产物是
的还原产物是![]() ,由此可知用
,由此可知用![]() 消毒自来水的效益是相同质量
消毒自来水的效益是相同质量![]() 的倍数是
的倍数是
[ ]
A.2 B.2.5 C.2.63 D.3.36
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
自来水用氯气消毒沿用已久,现在正研究采用二氧化氯(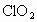 )消毒自来水.其优点为
)消毒自来水.其优点为
①减少了水的异味与毒性;
②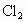 能与水中含有的某些有机物反应生成对人体有害的物质,而
能与水中含有的某些有机物反应生成对人体有害的物质,而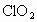 则不能;
则不能;
③等质量的消毒剂,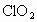 的消毒能力比
的消毒能力比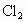 高.若两者的消毒原理相同,试计算等质量
高.若两者的消毒原理相同,试计算等质量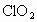 和
和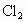 ,其消毒能力前者是后者的多少倍?
,其消毒能力前者是后者的多少倍?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com