
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO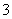 )、c(NO
)、c(NO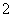 )和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
(1)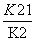
(2)2.5×10-2 75% > 不变 升高温度
(3)c(NO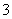 )>c(NO
)>c(NO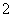 )>c(CH3COO-) b、c
)>c(CH3COO-) b、c
[解析] (1)反应(Ⅰ)×2-反应(Ⅱ)即得到反应:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),利用平衡常数定义可知该反应平衡常数K=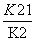 。(2)平衡时容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10 min×2 L=0.15 mol,则平衡后n(Cl2)=0.1 mol-
。(2)平衡时容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10 min×2 L=0.15 mol,则平衡后n(Cl2)=0.1 mol-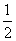 ×0.15 mol=0.025 mol;NO的转化率=
×0.15 mol=0.025 mol;NO的转化率=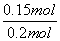 ×100%=75%;若恒压下达到平衡态相当于将原平衡加压,平衡正向移动,NO的转化率增大;平衡常数只与温度有关,恒压下达到平衡的平衡常数与原平衡常数相等;因该反应为放热反应,升高温度,反应逆向进行,反应平衡常数减小 。(3)反应后得到溶液A为物质的量浓度均为0.1 mol/L的NaNO2与NaNO3的混合溶液,利用已知电离常数可知CH3COO-水解程度大于NO
×100%=75%;若恒压下达到平衡态相当于将原平衡加压,平衡正向移动,NO的转化率增大;平衡常数只与温度有关,恒压下达到平衡的平衡常数与原平衡常数相等;因该反应为放热反应,升高温度,反应逆向进行,反应平衡常数减小 。(3)反应后得到溶液A为物质的量浓度均为0.1 mol/L的NaNO2与NaNO3的混合溶液,利用已知电离常数可知CH3COO-水解程度大于NO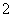 ,NO
,NO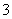 不发生水解,两溶液中c(NO
不发生水解,两溶液中c(NO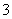 )>c(NO
)>c(NO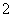 )>c(CH3COO-);利用CH3COO-水解程度大于NO
)>c(CH3COO-);利用CH3COO-水解程度大于NO 可知溶液B的碱性强于溶液A,为使溶液A、B的pH相等,可采取的措施有向溶液A中加适量NaOH或向B溶液中加入适量水稀释或向B溶液中加入适量稀醋酸等。
可知溶液B的碱性强于溶液A,为使溶液A、B的pH相等,可采取的措施有向溶液A中加适量NaOH或向B溶液中加入适量水稀释或向B溶液中加入适量稀醋酸等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
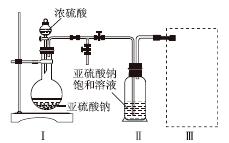
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
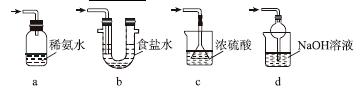
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
mmol C2H2跟nmol H2在密闭容器内反应,当达到平衡时,生成pmol C2H4。将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
A.(3m+n)mol B.( +
+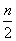 -3p)mol
-3p)mol
C.(3m+n+2p)mol D.( m+
m+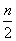 )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
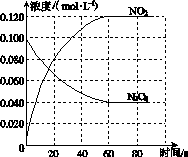
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180 s与180~240 s 区间的平均反应速率________、________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________(要求写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______________________________。
②设计实验方案:在不同H2O2浓度下,测定________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图中的装置示意图。
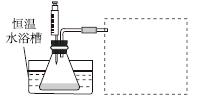
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
(2)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的__________(填“深”或“浅”),其原因是____________________________。
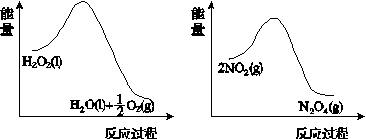
(a) (b)
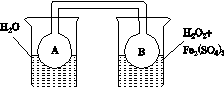
(c)
图21
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:( )
2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | |||
| 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
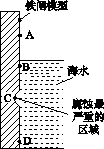
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
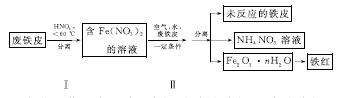
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com