

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¼īŠŌŠæĆĢøɵē³ŲŹĒ¶ž“Īµē³Ų |
| B£®Ē¦Šīµē³ŲŹĒŅ»“Īµē³Ų |
| C£®¶ž“Īµē³ŲÓÖ½ŠŠīµē³Ų£¬Ėü·ÅµēŗóæÉŅŌŌŁ³äµēŹ¹»īŠŌĪļÖŹ»ńµĆŌŁÉś |
| D£®Č¼ĮĻµē³ŲµÄ»īŠŌĪļ֏ƻӊ“¢“ęŌŚµē³ŲÄŚ²æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
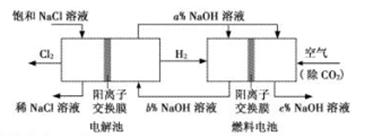
 ·ØÕżČ·µÄŹĒ
·ØÕżČ·µÄŹĒ| A£®µē½ā³ŲµÄŅõ¼«·“Ó¦Ź½ĪŖ2H2O+2e-=H2”ü+2OH- |
| B£®ĶØČėæÕĘųµÄµē¼«ĪŖøŗ¼« |
| C£®µē½ā³ŲÖŠ²śÉś2mol Cl2£¬ĄķĀŪÉĻČ¼ĮĻµē³ŲÖŠĻūŗÄ0.5 mol O2 |
| D£®a”¢b”¢cµÄ“󊔹ŲĻµĪŖ£ŗa>b=c |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®µē³Ų·ÅµēŹ±£¬Ä³µē¼«ÉĻµē¼«·“Ó¦ĪŖ£ŗNi3++e£”ś Ni2+ |
| B£®µē³Ų·ÅµēŹ±£¬Ni(OH)2µÄŗ¬Įæ²»¶Ļ¼õÉŁ |
| C£®µē³Ų³äµēŹ±£¬ÄųŌŖĖŲ±»»¹Ō |
| D£®µē³Ų·ÅµēŹ±£¬H2ŹĒøŗ¼« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 LaNi5+6Ni(OH)2£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄ
LaNi5+6Ni(OH)2£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄ| A£®·ÅµēŹ±“¢ĒāŗĻ½š×÷Õż¼« |
| B£®·ÅµēŹ±øŗ¼«·“Ó¦£ŗLaNi5H6 + 6OH££ 6e££½ LaNi5 + 6H2O |
| C£®³äµēŹ±Ńō¼«ÖÜĪ§c(OH£)Ōö“ó |
| D£®³äµēŹ±“¢ĒāŗĻ½š×÷Ņõ¼« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®·Ļ¾Éµē³ŲÓ¦¼ÆÖŠ»ŲŹÕ£¬²¢ĢīĀń“¦Ąķ |
| B£®ĒāÄܾßÓŠµÄÓŵćĪŖŅ×Č¼ÉÕ”¢ČČÖµøß”¢“¢“ę·½±ć |
| C£®Ē¦Šīµē³ŲŌŚ³äµēŹ±£¬½«µēÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ |
| D£®øɵē³Ų·ÅµēÖ®ŗó»¹ÄÜŌŁ³äµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
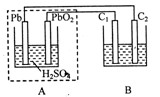
| A£®Ē¦Šīµē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬AÖŠČÜŅŗµÄPH±äŠ” |
| B£®µ±BÉÕ±ÖŠI-µÄÅØ¶Č½µĪŖ0.05mol/LŹ±£¬AÖŠĻūŗÄµÄ H2SO3µÄĪļÖŹµÄĮæĪŖ0.025mol |
| C£®µ±C1”¢C2Į½¼«¾łæŖŹ¼²śÉśĘųĢåŹ±£¬ÖĮÉŁŅŃÓŠ3.6”Į1022øöµē×Ó“ÓµēĀ·ÖŠĮ÷¹ż |
| D£®Ē¦Šīµē³Ų¹¤×÷Ź±£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗPbO2£2e -+ H2SO3 £½PbSO4+2H2O +SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®x¼«ĪŖµē³ŲµÄøŗ¼« | B£®x¼«ø½½üČÜŅŗµÄpHÖµ¼õŠ” |
C£®y¼«·¢ÉśŃõ»Æ·“Ó¦ | D£®µēĮ÷ÓÉy¼«Į÷Ļņx¼« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H2ĪŖøŗ¼«£¬O2ĪŖÕż¼« | B£®øŗ¼«·“Ó¦£ŗ2H2 +4OH-”ś4H2O + 4e- |
| C£®¹¤×÷Ź±µē½āÖŹČÜŅŗµÄPH²»¶ĻŌö“ó | D£®Õż¼«·“Ó¦£ŗO2 + 4e- +2 H2O”ś4OH- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com