



 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
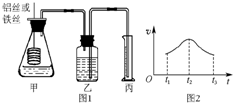 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
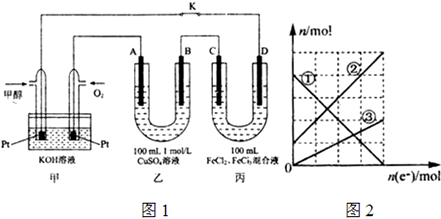
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定,开始时溶液的pH通常变化缓慢,当接近滴定终点时,pH 出现突变,称为滴定突跃 |
| B、结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |
| C、抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 |
| D、在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
| B、过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果 |
C、由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物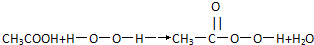 |
| D、浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com