
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示,且实验测得A室混合气体的质量为34 g。则下列说法中不正确的是( )
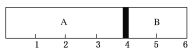
A. A室中混合气体所含分子总数为2NA
B. A室中混合气体的密度是同温同压下氢气密度的8.5倍
C. A室中混合气体中H2与O2的物质的量之比为1:1
D. 将A室H2、O2的混合气体点燃引爆,恢复到室温后,最终活塞恰好停留在3刻度处
【答案】D
【解析】
A.A、B两室压强与温度相同,气体的物质的量之比等于其气体体积之比,则A室中气体物质的量为1mol×4/2=2mol,含有分子数目为2NA,故A正确;B.A室中混合气体的平均摩尔质量为M=34g/2mol=17g/mol,同温同压下气体的密度之比等于其摩尔质量之比,故该混合气体的密度是同温同压条件下氢气密度17/2=8.5倍,故B正确;C.设氢气物质的量为xmol、氧气物质的量为ymol,则:x+y=2 ;2x+32y=34,计算得出x=1、y=1,则H2与O2的物质的量之比为1mol:1mol=1:1,故C正确;D. 将A室H2、O2的混合气体点燃引爆,氢气完全反应消耗0.5mol氧气,恢复到室温后,水为液态,A室还剩余0.5mol氧气,所以最终活塞停留在2刻度处,故D错误;答案:D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
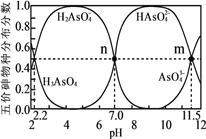
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示。A中原子堆积方式为________堆积,A、B中R原子的配位数之比为________。
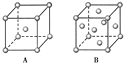
(2)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.9 g/cm3。

试求:
①图中正方形边长=________cm(只列出计算式,NA表示阿伏加德罗常数的值)。
②试计算单质D晶体中原子的空间利用率:________(列出计算式并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一氧化碳和二氧化碳的混合气体5.6L,如果二氧化碳的质量为2.2g,则一氧化碳的质量为( )
A. 5.6g B. 4.4g C. 2.8g D. 1g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,实验室可用如图装置制取无水氯化铁(已知:FeCl3固体易吸收空气中的水发生潮解)。请回答下列问题:

(1)盛放浓盐酸的仪器名称为_______________。
(2)烧瓶中发生反应的化学方程式为__________________________________。
(3)C瓶中的试剂是________________。
(4)玻璃管D中发生反应的化学方程式为______________________________,反应现象是__________________________。
(5)干燥管E中盛有碱石灰,其作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式为______________________,该化合物是通过________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式是_________________。
(3)Na3N与水的反应属于________反应。
(4)比较Na3N中两种粒子的半径大小________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为a kJ/mol 和b kJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和液态水。反应的热化学方程式为______________。(△H用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:

①分析可知X为_______________(写化学式),0~t1时间段的反应温度为_______________,0~t1时间段用SO2表示的化学反应速率为______________________;
②总反应的化学方程式为___________________________________________;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
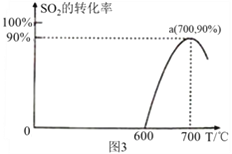
①该反应的ΔH______0(填“>”或“<”);
②700℃的平衡常数为_____________________;
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为___________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___________。(已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合后发生反应:SO2(g)+NO2(g) ![]() NO(g) +SO3(g)
NO(g) +SO3(g)
在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”); NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
(2)高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)===2NO(g)。估算自发进行的最低温度是__________℃。[已知该反应:ΔH=+180.50kJ/mol,ΔS=+247.7 J/(mol·K)]
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(4)用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为________________(用a、b、x表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com