
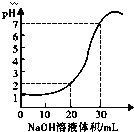
 如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )
如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )| A | B | C | D | |
| x | 0.12 | 0.04 | 0.03 | 0.09 |
| y | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
| 10c(HCl)-20c(NaOH) |
| 30 |
| 10c(HCl)-20c(NaOH) |
| 30 |


科目:高中化学 来源: 题型:
| A、1 | B、1.000 |
| C、1.007 | D、1.008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
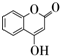 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成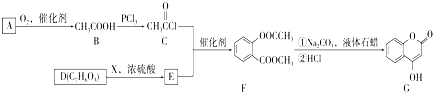
查看答案和解析>>
科目:高中化学 来源: 题型:
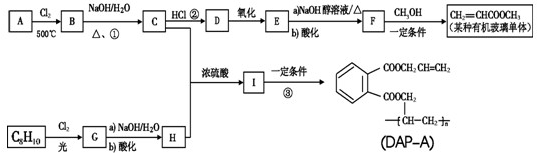
| 500℃ |
| NaOH |
| 酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
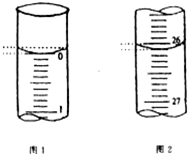 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
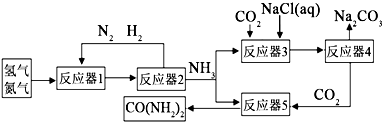
| ||
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com