
分析 (1)负极发生氧化反应,正极发生还原反应,充电时阳极与电源的正极相连,发生氧化反应;
(2)Cu作阳极电解硫酸铜溶液时,阳极上Cu失电子发生氧化反应;
(3)含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀来解答.
解答 解:(1)①铅的化合价升高,发生氧化反应,电极反应式为:Pb+SO42--2e-=PbSO4,故答案为:Pb+SO42--2e-=PbSO4;
②二氧化铅是正极,发生还原反应,正极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,所以阳极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,故答案为:PbSO4+2H2O-2e-=PbO2+4H++SO42-;
(2)Cu作阳极电解硫酸铜溶液时,阳极上Cu失电子发生氧化反应生成铜离子而溶解,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)Fe2+与铁氰化钾K3[Fe(CN)6]反应生成具有特征蓝色的铁氰化亚铁沉淀:2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓;
故答案为:2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓.
点评 本题考查电极反应式的书写以及离子的检验,侧重考查学生对知识的迁移应用、需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
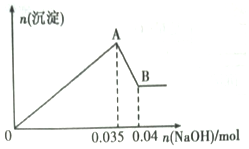 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
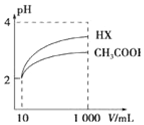 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
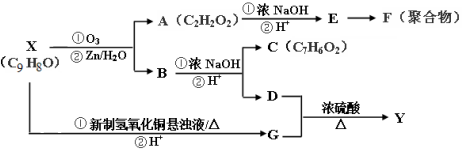
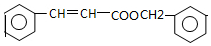 .
.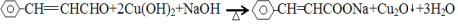 .
.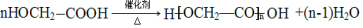 .
. .
.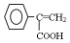 ,写出以
,写出以 为有机原料,制取H的合成路线(可任选无机原料).
为有机原料,制取H的合成路线(可任选无机原料).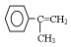 →
→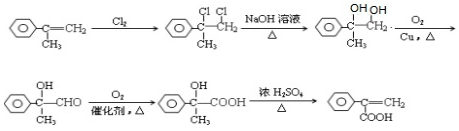 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
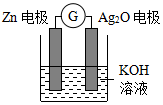 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
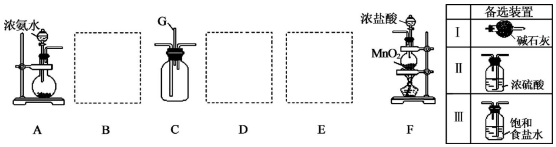
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com