
【题目】CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
![]()
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌被O2氧化生成FeOOH晶种。生成晶种的化学方程式为_________;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的________(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为_____。
(4)CoC2O4是制备钴的氧化物的重要原料;取18.3g CoC2O4·2H2O在空气中加热至350℃充分反应,生成钴氧化物8.03克。通过计算确定此钴氧化物的化学成分为___(填化学式)。
(5)另取一定量二水合草酸钴在某温度下分解产生的钴氧化物(其中所含Co的化合价为+2、+3)与560 mL 5 mol·L-1盐酸充分反应,钴氧化物恰好完全溶解,得到CoCl2溶液和标准状况下的黄绿色气体4.48 L。试确定该钴氧化物中Co、O的物质的量之比____。
【答案】 4FeSO4+8NaOH+O2![]() 4FeOOH+4Na2SO4+2H2O cde 除去空气,防止氢气与氧气混合反应爆炸 Co3O4 6:7
4FeOOH+4Na2SO4+2H2O cde 除去空气,防止氢气与氧气混合反应爆炸 Co3O4 6:7
【解析】(1)根据题意,反应物为FeSO4、NaOH、O2,产物为FeOOH,同时生成Na2SO4,化学反应方程式为:4FeSO4+8NaOH+O2 ![]() 4FeOOH+4Na2SO4+2H2O;
4FeOOH+4Na2SO4+2H2O;
(2)加热固体用坩埚,与其配套的有泥三角、三脚架、坩埚钳、酒精灯等,故选:cde;
(3)氢气易燃,在有氧气存在下加热会发生爆炸,故先用氮气排尽空气,防止氢气与氧气混合反应爆炸;
(4)18.3 gCoC2O4·2H2O的物质的量=![]() =0.1 mol,加热至350 ℃充分反应,生成钴的氧化物8.03 g,设该氧化物为CoxOy,则M(CoxOy)=59x+16y,n(CoxOy)=
=0.1 mol,加热至350 ℃充分反应,生成钴的氧化物8.03 g,设该氧化物为CoxOy,则M(CoxOy)=59x+16y,n(CoxOy)= ![]() mol,即:(59x+16y)
mol,即:(59x+16y) ![]() =8.03,解得x:y=3:4,钴氧化物的化学成分为Co3O4;
=8.03,解得x:y=3:4,钴氧化物的化学成分为Co3O4;
(5)n(HCl)=5 mol/L![]() 560 mL=2.8 mol,n(Cl2)=
560 mL=2.8 mol,n(Cl2)= ![]() =0.2 mol,n(Co)=[ n(HCl)- n(Cl2)
=0.2 mol,n(Co)=[ n(HCl)- n(Cl2) ![]() 2]
2] ![]() 2=1.2 mol,n(O)= n(HCl)
2=1.2 mol,n(O)= n(HCl) ![]() 2=1.4 mol,即n(Co): n(O)=6:7。
2=1.4 mol,即n(Co): n(O)=6:7。


科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃的叙述中,正确的是
A. 某物质的名称为2-乙基-1-丁烯,它的结构简式为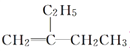
B. CH3—CH===CH—C≡C—CF3分子结构中6个碳原子可能都在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β—月桂烯的结构如图![]() 所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 .
(2)表中元素原子半径最大的是(写元素符号) .
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 .
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为﹣69℃和58℃.写出该反应的热化学方程式: .
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 . Q与水反应的化学方程式为 .
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL﹣1 NaOH溶液和1mol O2 , 则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( ) 
A.甲为原电池,乙、丙均为电解池
B.电子流动方向:电极Ⅳ→A→电极I
C.当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g
D.若丙中的电解质改为CuCl2 , 电极Ⅲ的电极反应发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mgL﹣1 . 我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mgL﹣1 . 某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH﹣═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I﹣氧化为I2:②MnO(OH)2+I﹣+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2;③2S2O32﹣+I2═S4O62﹣+2I﹣
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2 .
b.向烧瓶中加入200mL水样.
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量)开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000molL﹣1 Na2S2O3溶液进行滴定,记录数据.f…
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化).
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 .
(2)在橡胶塞处加入水样及有关试剂应选择的仪器是 .
①滴定管 ②注射器 ③量筒
(3)搅拌的作用是 .
(4)配平反应②的方程式,其化学计量数依次为 .
(5)步骤f为 .
(6)步骤e中达到滴定终点的标志为 . 若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=mgL﹣1(保留一位小数).作为饮用水源,此次测得DO是否达标:(填“是”或“否”)
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期元素.B、E同主族,且满足最高正化合价+最低负化合价=0;A与C、D与C之间都能形成原子个数比分别为2:1和1:1的两种化合物.试解答下列有关问题.
(1)在A2C2分子中含有的化学键是和 .
(2)C与D形成的化合物的电子式为 .
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为 .
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(g)2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.V(A)=0.5 mol/(Lmin)
B.V(B)=1.2 mol/(Lmin)
C.V(C)=0.4 mol/(Lmin )
D.V(C)=1.1 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com