
【题目】某同学以一种工业废渣(主要成分为MgCO3和少量C、Al2O3、FeSO4等)为原料制备MgCO3·3H2O,其设计的实验流程如下:
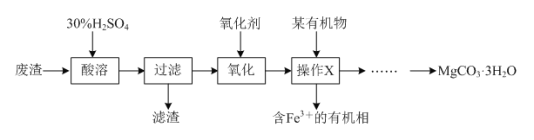
(1)质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为__________。
(2)滤渣的化学式为________;操作X的名称为__________,该操作需要的玻璃仪器是___________。
(3)已知:在下列实验中,当溶液中pH=8.5时,Mg(OH)2开始沉淀;pH=5.0时,Al(OH)3沉淀完全。请补充完整由操作X得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,________,过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
【答案】3.6 mol·L-1 C 萃取、分液 分液漏斗、烧杯 至pH介于5.0~8.5之间,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀
【解析】
由流程图可知,向工业废渣中加入30%硫酸,MgCO3和Al2O3与硫酸反应溶解,FeSO4溶解,C不反应,则过滤后得到含有镁离子、铝离子和亚铁离子的滤液和碳滤渣;向滤液中加入氧化剂,将亚铁离子氧化为铁离子,再加入有机溶剂,萃取分液除去溶液中的铁离子,得到含有镁离子、铝离子的水溶液,向水溶液中溶液中滴加氨水,控制溶液pH在5.0~8.5之间除去铝离子,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
(1)由c=![]() 可得质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为
可得质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为![]() =3.6mol/L,故答案为:3.6mol/L;
=3.6mol/L,故答案为:3.6mol/L;
(2)由分析可知,滤渣为不溶于水,不能与30%硫酸反应的碳,化学式为C;操作X的目的为加入有机溶剂,萃取分液除去溶液中的铁离子,分液用到的仪器:分液漏斗、烧杯;故答案为:C;萃取、分液;分液漏斗、烧杯;
(3)由当溶液中pH=8.5时,Mg(OH)2开始沉淀,pH=5.0时,Al(OH)3沉淀完全可知,由操作X得到的水溶液制备MgCO3·3H2O时,应先加入氨水控制溶液pH在5.0~8.5之间除去铝离子,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O,故答案为:至pH介于5.0~8.5之间,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
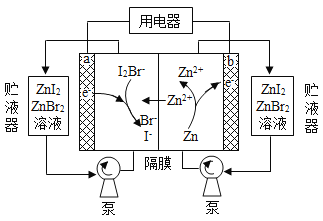
A. 放电时,a电极反应为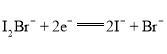
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.从1L 1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5L 2mol/L的氯化钡溶液中,含有的氯离子数为2×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10mL 18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图,有关M的下列叙述中正确的是

A. 可与H2反应,1 molM最多消耗1 molH2
B. 可与浓溴水反应,1molM最多消耗4 molBr2
C. 可与NaOH溶液反应,1 mol M最多消耗3 molNaOH
D. 常温下,M在水中的溶解度小于苯酚在水中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
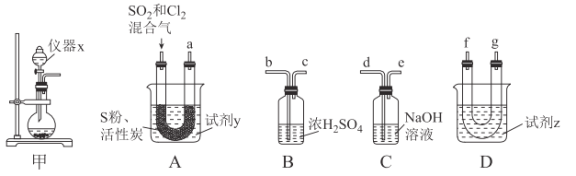
请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是
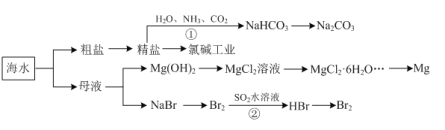
A.由反应①可知:相同温度下,NaHCO3的溶解度大于Na2CO3
B.MgCl2溶液通过蒸发浓缩、冷却结晶可获得MgCl2·6H2O
C.反应②的离子方程式为:Br2+SO2+2H2O=SO42—+2Br—+4H+
D.粗盐中含有的Mg2+、SO42—等杂质离子,可通过依次加入BaCl2溶液、NaOH溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速易行的方法:首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝依然光亮。
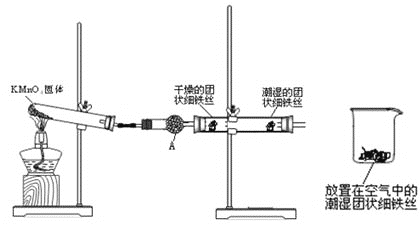
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___,能表示其原理的正极反应式为_________,负极反应式为________;
(2)仪器A的名称为____,其中装的药品可以是____,其作用是_____________;
(3)由实验可知,该类铁生锈的条件为_____。决定铁生锈快慢的一个重要因素是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有硫酸镁和硫酸钠两种溶质,选择合适的试剂将溶液中的镁离子转化为沉淀分离出来,设计实验流程如下:
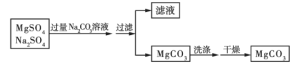
(1)欲证明滤液中存在![]() 、
、![]() ,选用的方案是先取少量的滤液,向其中滴加过量的______,发现有气泡生成,再向其中加入______溶液,出现白色沉淀,则可证明
,选用的方案是先取少量的滤液,向其中滴加过量的______,发现有气泡生成,再向其中加入______溶液,出现白色沉淀,则可证明![]() 、
、![]() 均存在。
均存在。
(2)洗涤碳酸镁沉淀的方法是____________。
(3)如何检验碳酸镁沉淀是否洗涤干净?____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com