
| A. | 金属钠保存煤油中 | B. | 浓硝酸存放于棕色试剂瓶中 | ||
| C. | 白磷保存在水中 | D. | NaOH溶液用玻璃塞密封保存 |
分析 A.钠能分别与水和氧气等反应,钠的密度比水的小比煤油的大;
B.见光易分解的药品应该用棕色试剂瓶存放;
C.白磷在空气中能自燃;
D.NaOH与二氧化硅反应反应生成粘性的硅酸钠.
解答 解:A.钠能分别与水和氧气等反应,钠的密度比水的小比煤油的大,所以少量的金属钠应保存在煤油中,隔绝空气,故A正确;
B.浓硝酸见光易分解,通常保存在棕色试剂瓶中,故B正确;
C.白磷在空气中能自燃,应保存在水中,故C正确;
D.NaOH与二氧化硅反应生成的硅酸钠具有粘合性,则不能使用玻璃塞,所以NaOH溶液盛放在带橡皮塞的细口瓶中,故D错误.
故选D.
点评 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:多选题
 )脱氢生成苯是放热反应,反应约为23.4kJ/mol,此事实能说明( )
)脱氢生成苯是放热反应,反应约为23.4kJ/mol,此事实能说明( )| A. | 1,3-环己二烯加氢是吸热反应 | |
| B. | 1,3-环己二烯的碳架变为苯环后,并不是简单的形成一个新的双键,而是具有了一个特殊稳定结构 | |
| C. | 1,3-环己二烯不及苯稳定 | |
| D. | 1,3-环己二烯加氢生成环己烷是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )
晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )| A. | 每个硼分子含有12个硼原子 | B. | 晶体硼是空间网状结构 | ||
| C. | 晶体硼中键角是60° | D. | 每个硼分子含有30个硼硼单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 醋酸钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ①、②两溶液相比,后者对水的电离的抑制程度大于前者 | |
| B. | ③、④两种溶液中分别加水稀释100倍,pH变化较大的是③ | |
| C. | 等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者 | |
| D. | ①、④两溶液等体积混合后,溶液中微粒浓度满足c(NH4+)+c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:2:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
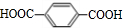 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )
假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )| A. | |△H1|>|△H2| | B. | |△H1|<|△H3| | ||
| C. | △H1+△H2+△H3=0 | D. | 甲-→丙的△H=△H1+△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com