
【题目】下列有关说法正确的是 ( )
A. CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
C. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D. 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,则有关说法正确的是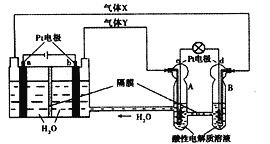
A. 当有0.1mol电子转移时,a极产生1.12LO2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e―=2H2↑+4OH―
C. d极上发生的电极反应是:O2+4H++4e―=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧可与多种元素形成化合物,设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 7.2 g CaO2晶体中阴离子数目为0.2NA
B. 4.0 g H![]() O中所含电子数为2NA
O中所含电子数为2NA
C. 6.2 g Na2O溶于100 mL水中所得溶液的物质的量浓度为2 mol·L-1
D. 标准状况下,将22.4 L Cl2通入足量水中发生反应,转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2O2(过氧化钠)与H2O反应的方程式是: 2Na2O2+2H2O =4NaOH+O2↑,将一定质量的Na2O2固体加入足量水中充分反应可生成O2 3.36L标准状况,试计算:
(1)参加反应的Na2O2固体质量为_____________克?
(2)反应后所得溶液加入2 mol/L硫酸溶液_____________毫升恰好被中和?(要求两步均写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. 晶体硅的熔点高、硬度大,可用作半导体材料
B. 浓H2SO4具有脱水性,可用来干燥HCl
C. 明矾易溶于水,可用作净水剂
D. Na具有强还原性,可用于高温下与TiCl4反应制备Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙-66是一种重要的合成纤维,它是由己二酸和己二胺[H2N—(CH2)6-NH2]以相等的物质的量在一定条件下聚合而成的,下列叙述中不正确的是( )
A. 尼龙-66的结构简式是
B. 合成尼龙-66的反应属于缩聚反应
C. 合成尼龙-66的反应基础是酯化反应
D. 尼龙-66的长链结构中含有肽键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的几种物质:①Cu②熔融NaCl③NaHSO4④CO2⑤H2SO4⑥酒精⑦KHCO3溶液⑧BaSO4⑨液氨。请按下列分类标准回答问题。
(1)属于电解质的是________________;(2)非电解质的是______________;(3)能导电的是_____;
(4)写出下列物质的电离方程式:NaHCO3:____________________________;NaHSO4(熔融): _________;A12(SO4)3_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略)。

已知:①NaClO溶液在受热或酸性条件下易分解,如: 3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl- +2H2O
Ag(NH3) 2++ Cl- +2H2O
③常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3) 2+ :
4 Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+ N2↑+ 4
4Ag↓+ N2↑+ 4![]() + 4NH3↑+H2O
+ 4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,该反应的化学方程式为_____________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是___________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为___________________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有: 2 mol·L-1水合肼溶液,1 mol·L-1H2SO4 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS溶液的pH___7(填“>”“=”或“<”),理由是_________________________________。
(2)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com