
 ,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O,
,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O, ;离子键、共价键;H++NH3?H2O═NH4++H2O;
;离子键、共价键;H++NH3?H2O═NH4++H2O;

科目:高中化学 来源: 题型:
| A、质子数、中子数均为1的核素:1H |
| B、漂白粉的有效成分的化学式:CaClO |
C、Cl-的离子结构示意图: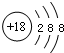 |
| D、碳酸钠的电离方程式:Na2CO3=2Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
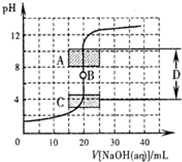 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.| 实验序号 | 消耗0.1032mol?L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
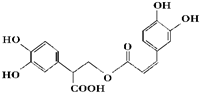
| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和含6mol NaOH的水溶液完全 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和9mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com