
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
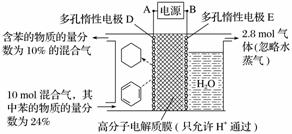
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
答案 ①A→D ②C6H6+6H++6e-===C6H12
③64.3%
解析 由图可知,苯转化为环己烷的过程是加氢过程,发生还原反应,故为阴极反应,所以A为电源的负极,B为电源的正极。
①电子从负极流向阴极,即A→D。
②该装置的目标是从苯到环己烷实现储氢,电极反应式为C6H6+6H++6e-===C6H12。
③阳极反应式为2H2O-4e-===O2↑+4H+,生成2.8 mol氧气,失去11.2 mol电子。电解过程中通过阴、阳极的电子数目相等,即阴极得到电子也为11.2 mol。阴极除生成环己烷外,还生成H2:2H++2e-===H2↑,由题意可知,2n(H2)+6n(C6H12)=11.2 mol,[10 mol+n(H2)]×10%=10 mol×24%-n(C6H12);解得n(H2)=2 mol,n(C6H12)=1.2 mol,故生成1.2 mol C6H12时转移电子1.2 mol×6=7.2 mol,电流效率η=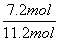 ×100%≈64.3%。
×100%≈64.3%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
 (1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
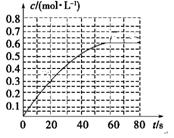
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g)
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变
化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
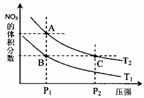 a.A、C两点的反应速率:A>C
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
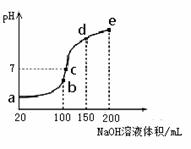 (3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式_______________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式___________________________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式__________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应化学方程式______________________________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式_________________________________________________________________;
阴极反应式________________________________________________________________;
总反应离子方程式______________________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式______________________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式_________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式______________________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式______________________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________。
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
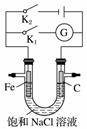
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
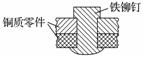
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解100 mL 4 mol·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
A.2.7 mol·L-1 B.3 mol·L-1
C.4 mol·L-1 D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO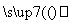 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com