
【题目】1mol某烷烃可与8molCl2完全取代,则此烷烃的分子式为( )
A.CH4B.C2H6C.C3H8D.C4H10
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为1NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.01NA
C.通常状况下,1NA个CO2分子占有的体积为22.4L
D.氧气和臭氧组成的4.8g混合气体中含有0.3NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ.氮的活化

工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如右图所示:(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂
B. 升高温度
C. 增加NH3的物质的量
D.压缩体积
E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A.容器中气体密度不变
B. 容器中压强不变
C.3v(H2)正=2v(NH3)逆
D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在25℃,101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol
2NH3(g) △H1= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2= -571.6kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近发现一种新微粒O4,有关这种新微粒的说法正确的是
A. 它的结构与P4相同
B. 它的摩尔质量为64
C. 它是氧气的同素异形体
D. 它是由两个氧分子通过分子间作用力结合而成的新微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/mL,质量分数为36.5%的浓盐酸配制250mL0.1mol/L的盐酸溶液,请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液应量取浓盐酸体积____mL ,除量筒、烧杯、玻璃棒外还需要的其它仪器有____、_______。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 C.将已冷却的盐酸沿玻璃棒注入容量瓶中 D.将容量瓶盖紧,振荡,摇匀 E.定容,使溶液凹面恰好与刻度相切 F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_____,溶液注入容量瓶前需恢复到室温,这是因为____。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
a.没有进行A操作______;
b.加蒸馏水时不慎超过了刻度____;
c.容量瓶用蒸馏水洗涤后未干燥即配溶液________;
d.溶液未冷却至室温就转移至容量瓶______。
(5)若实验过程中出现如下情况如何处理?向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摇头丸”是毒品中的一种,其中含有国家监管的药品——氯胺酮,它有致幻作用,在一定条件下发生一系列转化:
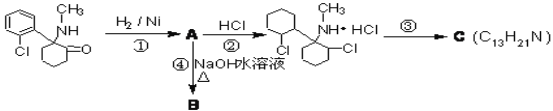
(1)氯胺酮中含氧官能团名称为__________,上述转化过程中发生加成反应的是_____(填序号)
(2)反应③的条件__________,C的结构有两种,其中一种结构只含有一个手性碳原子(连接四个不同原子或原子团的碳原子叫手性碳原子),其结构简式为__________
(3)步骤④的化学反应方程式_____________________________________________
(4)有一种去甲基氯胺酮D,能发生如下反应:(已知:琥珀醛酸的分子式为C4H6O3)

①由E→F的转化过程中,氰基硼氢化钠所体现的性质为_____________________
②H的分子式为_______________________
③M的分子式为C10H10O3 ,符合下列条件的同分异构体有___________种
i与琥珀醛酸具有相同官能团 ii含苯环且苯环上有两个取代基
④N是与琥珀醛酸具有相同官能团一种同分异构体,以N为主要原料合成 ___________
___________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO3-和SO32-,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是

A. a表示SO32-物质的量分数随溶液pH变化的曲线
B. pH=8昀溶液中:c(HSO3-)>c(SO32-)
C. pH=7的溶液中:c(Na+)= c(HSO3-)+2c(SO32-)
D. 1mol/L的NaHSO3溶液中存在: c(H2SO3)=c(H+)+c(OH-)+c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】儿种短周期元素的原子半径及主要化合价如下表

下列说法不正确的是
A. 由元素X和Q组成的化合物可能含有共价键
B. X、Z、R的最高价氧化物对应水化物可彼此反应
C. 离子半径:r(M2-)<r(R3-)
D. Z和Y形成的化合物为离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com