
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO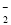 ,下列说法正确的是( )
,下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
A
【解析】
试题分析:镍氢电池中主要为KOH作电解液 充电时,阳极反应:Ni(OH)2+OH-=NiOOH+H2O+e-、阴极反应:M+H2O+e-=MH+OH-,总反应:M+Ni(OH)2=MH+NiOOH;放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH-=M+H2O+e-,总反应:MH+NiOOH=M+Ni(OH)2以上式中M为储氢合金,MH为吸附了氢原子的储氢合金。A、正极的电极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-,故A正确;B、电解时阴离子向阳极移动,阳离子向阴极移动,所以OH-离子从阴极向阳极,故B错误;C、H2O中的H得电子,不是被M还原,故C错误;D、不能用氨水做电解质溶液,因为NiOOH能和氨水发生反应,故D错误。
考点:本题考查原电池与电解池原理。


科目:高中化学 来源:2015届山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:实验题
(11分)某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
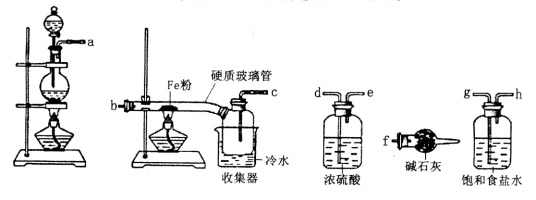
(1)装置的连接顺序为a→____→_____→_____→_____→_____→____→f。
(2)硬质玻璃管中可观察到的现象是______________。
(3)硬质玻璃管与收集器之间没有用导管连接,原因是______________。
(4)反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①试剂X的化学式为_________;
②有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理’,或“不合理,);固体产物的成分可能为________(填相应的字母);
a.Fe和FeCl3 b.FeCl2和FeCl3 c.Fe、FeCl2和FeCl3 d.Fe和FeCl2
③用离子方程式表示加入新制氯水后溶液红色加深的原因______________。
(5)该小组同学对红色褪去的原因进行探究。
①提出假设:
假设1:溶液中无SCN-
假设2:溶液中无Fe3+
假设3:____________。
②设计方案:请对所提出的假设1进行验证,简要写出实验方案。___________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:填空题
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO 、NO
、NO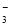 、CO
、CO 、Cl
、Cl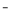 。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
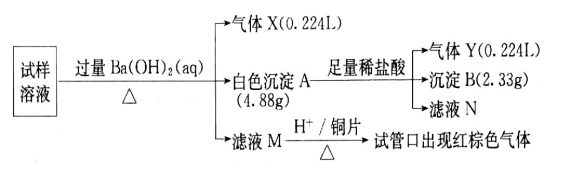
回答下列问题:(注明:白色沉淀A4.88g改为4.30g)
(1)检验气体X通常使用的试剂是______________________;
(2)沉淀B是_________,在沉淀A中加入足量稀盐酸后,溶解的沉淀是_________;
(3)试样中肯定不存在的离子是___________,不能确定是否存在的离子是______;
(4)滤液M在酸性条件下与铜片的反应中,还原产物是________________________。
(5)将实验中得到的气体Y全部通入10mL1.2mol·L 的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列叙述正确的是
A.非金属氧化物一定不是碱性氧化物
B.HCl、H2S、NH3都是电解质
C.漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离
D.Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(8分)肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。 该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
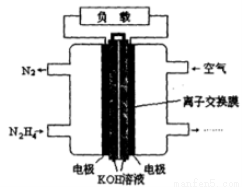
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
用如图所示装置处理含NO3—的酸性工业废水,某电极反应式为2NO3—+12H++10e-=N2+6H2O,则下列说法错误的是
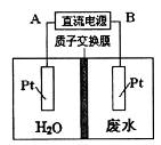
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6g N2,另一侧溶液质量减少l8g
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:实验题
(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
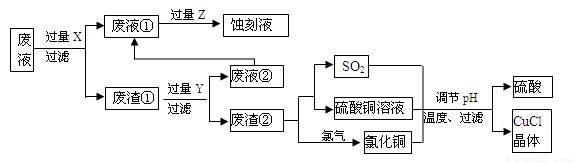
按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
下列物质与足量铁反应,转移电子数最少的是
A.1mol氯气 B.1mol S
C.含1molHNO3的稀硝酸 D.含1molCuSO4的硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到哪些仪器,且先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL容量瓶
⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com