
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
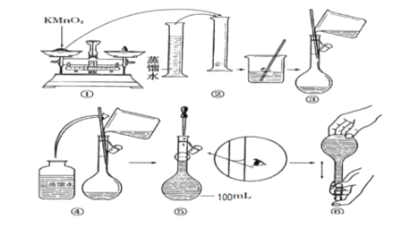
(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
【答案】②⑤ 100mL容量瓶 偏小 偏大 偏小 2 1.2mg/mL
【解析】
(1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合C=![]() 分析;
分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析写出化学方程式得到x;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度。
(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2) 配制l00m L酸性KMnO4标准溶液应该用100mL容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;如未冷却至室温就进行液体转移,液体热胀冷缩,冷却后则其所配的氯化钾溶液的浓度偏大;若用托盘天平时错把砝码放在左边,把药品放在右边称量,会导致溶质的物质的量偏小,则其所配氯化钾溶液的浓度将偏小;
(4) 草酸跟KMnO4反应的离子方程式为:2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据电荷守恒,(1×2)+(+1×6)=+x×2,解得x=2;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×104mol,根据反应方程式2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=![]() n(MnO4)=2.5×2.4×104mol=6×104mol,Ca2+的质量为:40g/mol×6×104mol=0.024g,钙离子的浓度为:
n(MnO4)=2.5×2.4×104mol=6×104mol,Ca2+的质量为:40g/mol×6×104mol=0.024g,钙离子的浓度为:![]() = 1.2mg/mL。
= 1.2mg/mL。


科目:高中化学 来源: 题型:
【题目】某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是ag/cm3 ,该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷 b mL,放入锥形瓶中。②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液,得白色沉淀。④过滤,洗涤,干燥后称重,得到cg固体。回答下面问题:
(1)装置中长玻璃管的作用是________________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的__________________离子。
(3)该卤代烷中所含卤素的名称是_____,判断的依据是______________。
(4)该卤代烷的相对分子质量是____________________。(用含a、b、c的代数式表示)
(5)如果在步骤③中加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值(填下列选项代码)___________。
A.偏大 B.偏小 C.大小不定 D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是___(填化学式)。
②配平该方程式:__NH3+__Cl2—__N2+__HCl
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是___,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为___。
②反应II属于___反应。(填四种基本反应类型之一)。
③若要制得a个氯气分子,则整个反应中转移电子的个数为___个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用香味剂是常见的食品添加剂之一。以苯酚为原料合成某食用香味剂(J)的路线:
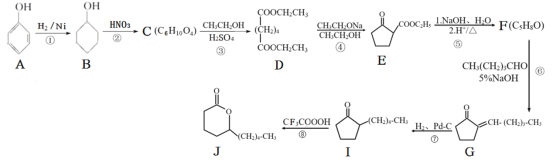
回答下列问题:
(1)B的名称是__________。反应⑦的类型属于__________。
(2)E中官能团名称是__________。若C与乙二醇(![]() )发生缩聚反应生成高聚物H,则H的结构简式为__________。
)发生缩聚反应生成高聚物H,则H的结构简式为__________。
(3)F的结构简式为__________。
(4)与反应⑧相似,![]() (甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化生成的主要产物是__________。
(甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化生成的主要产物是__________。
(5)R是G的同分异构体。R能发生银镜反应,核磁共振氢谱为三组峰,峰面积之比为9:6∶1,R可能的结构简式为_____________________。
(6)根据上述流程中合成食用香味剂(J)的原理,设计由![]() 制备
制备![]() 的合成路线。(无机试剂任选)__________。
的合成路线。(无机试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:
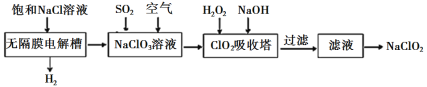
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________(写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________,H2O2的电子式为________。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______g·L1(杂质不参与反应,NaClO2中的氯元素被还原为Cl)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液中含有 大量 的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴,(Br2常温下是深红棕色液体),设计了如下的流程图:
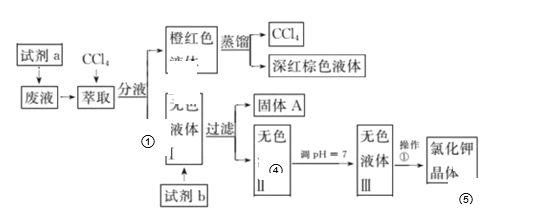
可供选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2 溶液(H+)、KMnO4溶液(H+)、盐酸。请根据流程图回答相关问题 :
(1)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl,
①发生反应的离子方程式为:___________。
②每消耗0.2mol H2O2,反应转移的电子数为_______mol。
③还原剂和还原产物的物质的量之比是_____________。
(2)操作①②③④⑤对应的名称分别是:萃取、_________、蒸馏、过滤、__________。蒸馏过程用到下图装置的名称是A____________ B____________。

(3)为了除去无色液体中的Ca2+、Mg2+、SO42-,从可供选则试剂中选择试剂b所代表的物质,按照滴加的顺序依次是_______、_________、_________(填化学式)。
(4)调节pH=7是为了除去杂质离子_______和________,以提高氯化钾晶体的纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
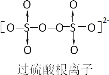
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(过硫酸根离子如图所示)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
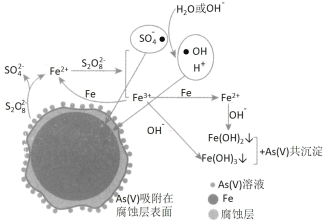
A.室温下,中间产物 Fe(OH)3 溶于水所得饱和溶液中 c(Fe3+)为2.7×10-18 mol·L-1
B.若 56g Fe 参加反应,共有 NA 个 S2O82- 被还原
C.1mol 过硫酸钠(Na2S2O8)含 2NA 个过氧键
D.pH 越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M为+2价金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能将工业废气(SO2)高效地还原成无公害的固体单质硫,防止环境污染。其流程为: MFe2Ox![]() MFe2Oy。则下列判断正确的是( )
MFe2Oy。则下列判断正确的是( )
A.MFe2Ox作催化剂B.SO2是该反应的还原剂
C.x<yD.SO2发生了置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com