
| ���ữѧʽ | HX | HY | H2CO3 |
| ����ƽ�ⳣ�� | 7.8�w10-9 | 3.7�w10-15 | K1=4.3�w10-7 K2=5.6�w10-11 |
 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NH3��H2O | B��CH3COOH | C������ | D��H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HCN | B��HF | C��CH3COOH | D��HNO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KClO3���� | B��Cl2 |
| C��HCl���� | D��KCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������AͶ��B������Һ�У�A�ܽ⣬˵��A�Ľ����Ա�B�Ľ�����ǿ |
| B���ȼҵ�ͽ����Ƶ�ұ�����õ���NaC1���ڵ��ʱ���ǵ���������C1-ʧ���� |
| C��pH��Ȣ�NH4HSO4��NH4C1�ۣ�NH4��2SO4��Һ�У�c��NH4+���Ĵ�С˳��Ϊ��>��>�� |
| D�������£����������Һ�м���������ˮ������Һ��pH=7ʱ��2c(SO42-)=c(NH4+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
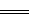 ��CH3COO��2Pb��
��CH3COO��2Pb��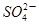 ���ݴ��жϴ���Ǧ��
���ݴ��жϴ���Ǧ��| A������ǿ����� | B������������� | C������ǿ����� | D������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
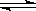 M(OH)2
M(OH)2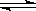 2H+ + MO22-
2H+ + MO22-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� | H�� | OH�� | CH3COO�� | CH3COOH |
| ���ʵ���Ũ�� | ���� | ��С | ��С | ���� |
| A���Ȼ��� | B���������� |
| C������ˮ | D������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com