
| A�� | ������NaHCO3��Na2CO3�ķֱ�������������ȫ��Ӧ��Na2CO3������CO2�� | |
| B�� | 84g NaHCO3��106g Na2CO3�ֱ���ͬŨ������������ȫ��Ӧ��Na2CO3�����������NaHCO3���� | |
| C�� | ������ʯ��ˮ��CaCl2��Һ�ֱ�����������Һ�У���ֻ��Na2CO3�������� | |
| D�� | ͨ������£�Na2CO3���ܽ�ȴ���NaHCO3 |
���� A����������Na2CO3��NaHCO3��̼���Ƶ�Ħ�������������ʵ����٣�
B�������ʵ�����Na2CO3��NaHCO3�ֱ���������ᷴӦ���ų�CO2һ���ࣻ
C�����߶�������������Һ��Ӧ���ɳ�����
D����ͬ�����£�̼�����Ƶ��ܽ��С��
��� �⣺A����������Na2CO3��NaHCO3��̼���Ƶ�Ħ�������������ʵ����٣���������������������ȫ��Ӧ��̼���Ʋ����������٣���A��ȷ��
B����������ᷴӦ���ɶ�����̼���壺Na2CO3+2HCl=2NaCl+H2O+CO2����NaHCO3+HCl=NaCl+H2O+CO2����106��Na2CO3��84��NaHCO3�����ʵ�������1mol�������ʵ�����Na2CO3��NaHCO3�ֱ���������ᷴӦ���ų�CO2������ȣ���B��ȷ��
C��Na2CO3��Ca��OH��2��Ϻ�����CaCO3������Na2CO3+Ca��OH��2=CaCO3��+2NaOH��NaHCO3�������ʯ��ˮ����Ca��OH��2+NaHCO3�TCaCO3��+NaOH+H2O��Ca��OH��2+2NaHCO3�TCaCO3��+Na2CO3+2H2O����C����
D��Na2CO3��NaHCO3����ͬ�����£�̼�����Ƶ��ܽ��С������ˮ�е��ܽ��Ϊ��Na2CO3��NaHCO3����D��ȷ��
��ѡC��
���� ���⿼��Na2CO3��NaHCO3���ʵ���ͬ����Ŀ�ѶȲ���ע�����Na2CO3��NaHCO3���ʣ�ע�ػ���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ⱥ�ͨ����ˮ�ͳ���ʯ��ˮ | |
| B�� | ��ȼ������Ϳ�г���ʯ��ˮ���ձ���ͨ����ˮ | |
| C�� | ��ȼ�����ϸ�������ձ� | |
| D�� | ��ȼ������Ϳ�г���ʯ��ˮ���ձ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ں�ˮ�б��ں�ˮ�и���ʴ����Ҫԭ���Ǻ�ˮ���������ں�ˮ | |
| B�� | ��������������ʴ��������ӦʽΪO2+2H2O+4e-�T4OH- | |
| C�� | �ں������������п�飬п���������ɼ�������ĸ�ʴ���� | |
| D�� | �ڳ�ʪ�Ŀ����У���п����ȶ����������ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
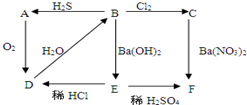 ͼ��AΪ����ɫ���壬B��CΪ��Һ��DΪ���壬E��FΪ��ɫ������
ͼ��AΪ����ɫ���壬B��CΪ��Һ��DΪ���壬E��FΪ��ɫ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/mol | 0.020 | 0.015 | 0.012 | 0.010 | 0.010 | 0.010 |
| A�� | ��0��2s�ڣ�v��O2��=0.002mol•L-1•s-1 | |
| B�� | 5s����������ͨ��0.02mol NO2���ٴ�ƽ���0.020mol��n��NO2����0.040 mol | |
| C�� | �ڸ��¶�ʱ���������м���O2��ƽ�⽫�����ƶ���ƽ�ⳣ������ | |
| D�� | 5s����Ӧ������ͬʱͨ���0.01mol��NO��O2��NO2��ƽ���������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��Ӧ | ��H/kJ•mol-1 | ��S/J•K-1•mol-1 |
| �� | -72.1 | +220 |
| �� | +149 | +41 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com