
| 实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
| 1 | 1.000 | 11.00 | 25.00 |
| 2 | 1.000 | 12.04 | 25.00 |
| 3 | 1.000 | 12.18 | 25.00 |
| 12.04+12.18 |
| 2 |
| 2×1.000mol/L×0.01211L |
| 0.025l |
| 40g/mol×0.9688mol/L×0.25L |
| 10.5g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温下水电离出的c(H+):pH=5的CH3COOH溶液>pH=5的盐酸 |
| B、微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C、等温等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3 |
| D、氢化物的沸点:H2Se>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
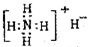


18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
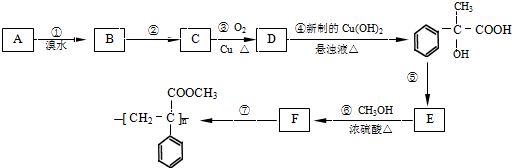
查看答案和解析>>
科目:高中化学 来源: 题型:
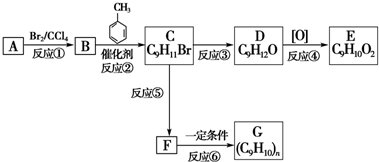
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 熔点/℃ | 64.7 | 249 | 199.6 |
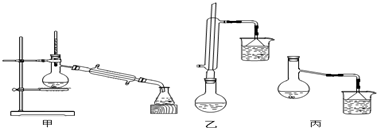
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时C为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
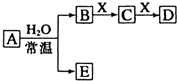 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com