
| A. | 100℃时,KW=10-12,此温度下pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明该溶液中c(HSO3-)>c(SO32-) | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 25℃时,10mL0.1mol/L CH3COOH溶液与5mL 0.1mol/LNaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |
分析 A、100℃时,KW=10-12,此温度下PH=6的溶液中:c(H+)=c(OH-)=1×10-6mol/L,该溶液一定为中性;
B、25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液显示酸性,只能说明HSO3-在水溶液中的电离程度大于其水解程度;
C、盐的水解对水的电离有促进作用;
D、根据溶液中物料守恒进行分析:n(CH3COO-)+n(CH3COOH)=0.001mol,n(Na+)=0.0005mol,所以同一溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH).
解答 解:A、水的离子积KW=10-12,纯水中c(H+)=c(OH-)=1×10-6mol/L,此温度下PH=6,溶液显示中性,故A错误;
B、25℃时,0.1mol/L的NaHSO3溶液pH=4,只能说明HSO3-在水溶液中的电离程度大于亚硫酸氢根离子的水解程度,但无论是HSO3-的电离程度还是水解程度均非常小,故c(HSO3-)>c(SO32-),故B正确;
C、盐的水解对水的电离有促进作用,故NH4Cl、CH3COONa、NaHCO3均能促进水的电离,但NaHSO4不水解,且溶于水后能电离出大量的氢离子,对水的电离有抑制作用,故C错误;
D、溶液中n(CH3COO-)+n(CH3COOH)=0.001mol、n(Na+)=0.0005mol,则n(CH3COO-)+n(CH3COOH)=2n(Na+),由于在同一溶液中,所以2c(Na+)=c(CH3COO-)+c(CH3COOH),故D正确;
故选BD.
点评 本题考查了水的电离、盐的水解等知识,题目难度中等,注意判断溶液酸碱性时,要根据溶液中氢离子与氢氧根离子的浓度大小进行判断;选项D为易错点,注意物料守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水、分液) | B. | 乙醇中的乙酸(NaOH溶液,分液) | ||
| C. | 乙醇中的水(新制CaO,蒸馏) | D. | 乙酸乙酯中的乙酸(NaOH溶液,分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
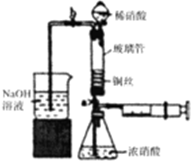 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
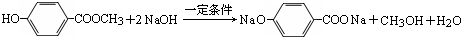 .
.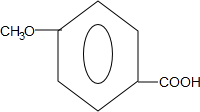 .
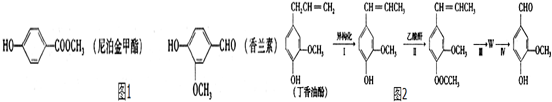
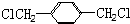
. 和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.
和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.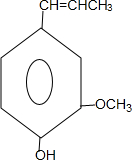 +CH3OCOCOCH3→
+CH3OCOCOCH3→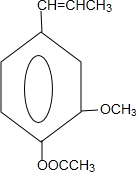 +CH3COOH.
+CH3COOH.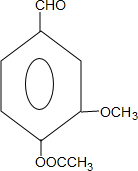 _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
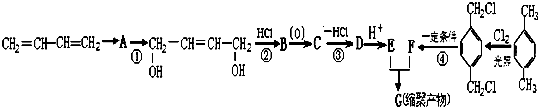
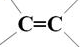 、-COOH.
、-COOH.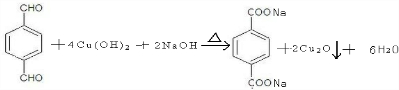 ;
;  .
. 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
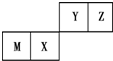
| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 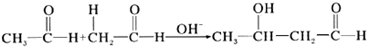 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 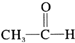 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com