
下列有关反应SiO2+3C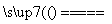 SiC+2CO↑的叙述中,正确的是 ( )。
SiC+2CO↑的叙述中,正确的是 ( )。
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是 ( )。
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为______________________________________________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________。
A.Mg2+ B.Fe2+
C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
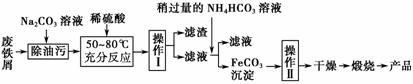
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为______________________________________________________________。
②请写出生成FeCO3沉淀的离子方程式:_________________________ _______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是 ( )。
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl2溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实及其解释不正确的是 ( )。
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
向21.6 g铁粉和铜粉的混合物中加入1 L 1 mol·L-1硝酸溶液,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO )可能为(忽略溶液体积的变化) ( )。
)可能为(忽略溶液体积的变化) ( )。
A.0.45 mol·L-1 B.0.6 mol·L-1
C.0.75 mol·L-1 D.0.9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年7月四川省部分地区遭遇强降雨天气,当地居民饮用水受到严重污染。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:

(1)高铁酸钾中铁元素的化合价为________,推测它具有的化学性质是__________________。
(2)在NaClO溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO +3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
+3Cl-+5H2O,氧化剂是________。将KOH加入反应后的溶液中搅拌半小时,静置,过滤粗产品,该过程发生的反应为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填“大于”、“小于”或“等于”)高铁酸钾的溶解度。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸钾(KCrO2)氧化为铬酸钾(K2CrO4),生成的铬酸盐溶解酸化后,得到的重铬酸钾(K2Cr2O7)用(NH4)2Fe(SO4)2标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬),有关反应的离子方程式为FeO +CrO
+CrO +2H2O===CrO
+2H2O===CrO +Fe(OH)3↓+OH-,2CrO
+Fe(OH)3↓+OH-,2CrO +2H+===Cr2O
+2H+===Cr2O +H2O,Cr2O
+H2O,Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL 容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液33.33 mL。计算上述实验制得的样品中高铁酸钾的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
恩格斯指出:“新创立的有机化学,它一个一个的从无机物创造出所谓的有机化合物,从而扫除了这些所谓有机物神秘性的残余。”
(1)请举例说明有机物和无机物之间是可以相互转化的(用化学方程式表示):
①有机物转化为无机物___________________________________。
②无机物转化为有机物________________________________。
(2)1828年,德国化学家维勒在制备无机盐氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液时得到尿素[CO(NH2)2]。尿素的人工合成,揭开了人工合成有机物的序幕。请回答下列问题:①制备氰酸铵的化学方程式是__________________。
②氰酸铵和尿素间的关系是________(填字母代号)。
A.同位素 B.同素异形体
C.同分异构体 D.同系物
③尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式
________________________________________________________________________。
(3)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式: ________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作中,能使电离平衡H2O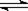 H++OH-向右移动且溶液呈碱性的是 ( )
H++OH-向右移动且溶液呈碱性的是 ( )
A.向水中通入氨气 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com