
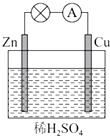
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )| A. | Cu为负极,Zn为正极 | B. | Cu极上有气泡产生,发生还原反应 | ||
| C. | SO42-向Cu极移动 | D. | 电子的流向是:Cu-→Zn |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
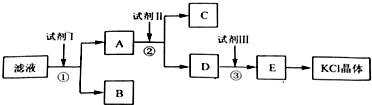
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
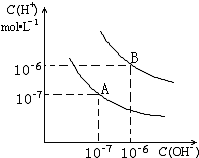 已知水在25℃和95℃时,电离平衡曲线如图所示:
已知水在25℃和95℃时,电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物E的名称是异丙烷 | B. | B与C及D毒为同分异构体 | ||
| C. | F与G互为同系物 | D. | A与H实验式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
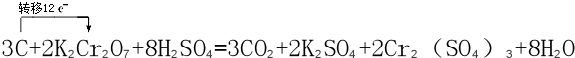
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q2=Q1 | B. | 2Q2<Q1 | C. | Q2<Q1<197kJ | D. | Q2=Q1<197kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com