
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:
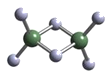
① 分子中A1原子采取____杂化。Al2Cl6属于____分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____。
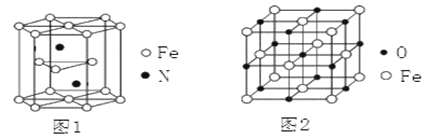
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2—的最短核间距为_____________pm。
【答案】六或6 哑铃形或纺锤形 1s22s22p63s23p63d5 sp3 非极性 BC  Fe3+的3d轨道是半充满 3:1 12
Fe3+的3d轨道是半充满 3:1 12 
【解析】
(1)钕(Nd)为60号元素,在周期表中位于第六周期。基态硼原子中占据的最高能级为2p,电子云轮廓图形状为哑铃形或纺锤形。铁原子的电子排布式为1s22s22p63s23p63d64s2,形成离子优先失去最外层电子,故铁离子的电子排布式1s22s22p63s23p63d5;
(2)①Al2Cl6分子中每个铝原子与四个氯原子形成共价键,故A1原子采取sp3杂化。Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于非极性分子;
②Al最外层的空轨可以接受氧原子提供的孤对电子形成配位键,O和H之间形成极性共价键,故选:BC;
(3)基态Fe2+的价电子排布式为3d6,则价电子排布图(轨道表达式)为 。Fe2+容易被氧化成Fe3+的原因是Fe3+的3d轨道是半充满,比较稳定;
。Fe2+容易被氧化成Fe3+的原因是Fe3+的3d轨道是半充满,比较稳定;
(4)氮化铁晶胞为六棱柱,顶点贡献率为![]() ,棱点贡献率为
,棱点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() 。观察晶胞可知,12个铁原子位于顶点,2个点位于面心,3个铁位于体内。2个氮位于体内。则1个晶胞含铁微粒数为12
。观察晶胞可知,12个铁原子位于顶点,2个点位于面心,3个铁位于体内。2个氮位于体内。则1个晶胞含铁微粒数为12![]() +2
+2![]() +3=6,含氮微粒数为2,则该晶体中铁、氮的微粒个数之比为6:2=3:1;
+3=6,含氮微粒数为2,则该晶体中铁、氮的微粒个数之比为6:2=3:1;
(5)观察图2可知,上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,而氧化亚铁晶体中氧离子、亚铁离子个数比为1:1,所以与Fe2+紧邻且等距离的Fe2+数目为12个。1个氧化亚铁晶胞含Fe2+数目为8![]() +6
+6![]() =4,含O2—数目为12
=4,含O2—数目为12![]() +1=4,所以,1个氧化亚铁晶胞含4个“FeO”,设Fe2+与O2—的最短核间距为d pm,有ρ=
+1=4,所以,1个氧化亚铁晶胞含4个“FeO”,设Fe2+与O2—的最短核间距为d pm,有ρ=![]() ,解得d=
,解得d=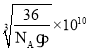 pm。
pm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物W在医药和新材料等领域有广泛应用。W的一种合成路线如图所示:
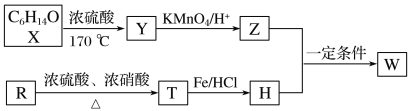
已知信息如下:
Ⅰ.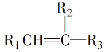
![]()
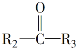 +R1COOH;
+R1COOH;
Ⅱ.![]() (具有还原性);
(具有还原性);
Ⅲ.RCH2NH2+
![]()
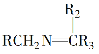 +H2O;
+H2O;
Ⅳ.R是苯的同系物,摩尔质量为106g·mol-1,R的一氯代物有5种,T为一硝基代物,H分子的核磁共振氢谱上有5组峰;
Ⅴ.1molY完全反应生成2molZ;
Ⅵ.苯甲酸的酸性比盐酸弱,苯甲酸与浓硫酸、浓硝酸在加热条件下主要发生间位取代反应。
请回答下列问题:
(1)X的化学名称是__;Z分子中官能团名称为__。
(2)T的结构简式为__;图示中X转化为Y的反应类型是__。
(3)Z和H在一定条件下反应生成W的化学方程式为__。
(4)G是T的同分异构体,G能和碳酸钠反应产生气体且分子中含有苯环和—NH2(氨基),G的结构有__种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为__。
(5)设计出以苯乙烯和丙酮为主要原料制备药物中间体(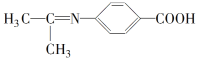 )的合成路线(其他试剂任选):__。
)的合成路线(其他试剂任选):__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(BaSO4)=1.0×10-10,Ksp(SrSO4)=3.0×10-7向20mL0.1mo1·L-1BaCl2溶液中滴加0.1mol·L-1的Na2SO4溶液,金属离子浓度与硫酸钠溶液体积的关系如图所示,已知:pM=-lgc(M2+)。下列说法正确的是( )
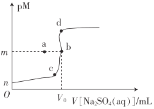
A.图像中,V0=20,m=5
B.在b点加少量BaCl2固体,Ksp(BaSO4)增大
C.若BaCl2溶液体积仍为20mL,浓度变为0.2mo1·L-1,则b点向a点迁移
D.若用SrCl2溶液替代BaCl2溶液,则b点向d点迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
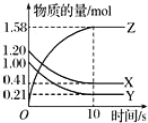
(1)写出该反应的化学方程式:___。
(2)列叙述中不能说明上述反应达到平衡状态的是___。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是___。
A.恒压时充入Ne
B.适当升高温度
C.缩小容器的体积
D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
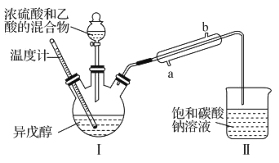
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. Mg(OH)2(s)![]() MgCl2(aq)
MgCl2(aq)![]() Mg(s)
Mg(s)
B. FeCl2(aq)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(OH)3(胶体)
Fe(OH)3(胶体)
C. 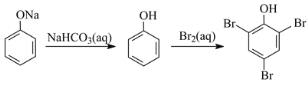
D. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列甲、乙、丙是常见的有机化合物,按要求回答下列问题:
甲:CH3CH=CH2 乙:![]() 丙:HOCH2CH2CH2COOH
丙:HOCH2CH2CH2COOH
(1)甲的名称是_______。
(2)甲能与溴的四氯化碳溶液反应,反应的化学方程式为______。
(3)甲也能发生聚合反应,产物的结构简式为_____________。
(4)丙与浓硫酸混合加热,生成五元环物质的化学反应方程式是____________。
(5)写出乙的同分异构体中,含苯环的且核磁共振氢谱有2组峰,峰面积比为3∶2的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com