
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
分析 水是氧化剂说明水中氢元素化合价降低,反应物中有氢气生成,由此分析解答.
解答 解:A、Cl2+H2O═HCl+HClO,水既不是氧化剂也不是还原剂,故A错误;
B、3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应中水中氢元素化合价降低是氧化剂,故B正确;
C、2Na2O2+2H2O═4NaOH+O2↑,水既不是氧化剂也不是还原剂,故C错误;
D、2F2+2H2O═4HF+O2反应中水中氧元素化合价升高是还原剂,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
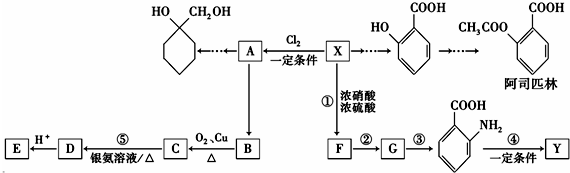

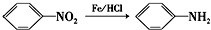 (苯胺,易被氧化)
(苯胺,易被氧化)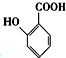 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2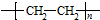
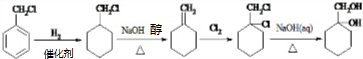 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中一定存在化学键 | |
| B. | 已知晶胞的组成就可推知晶体的组成 | |
| C. | 分子晶体在晶体态或熔融态下均不导电 | |
| D. | 原子晶体中只存在共价键,不可能存在其他类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有一句正确 | B. | 有两句正确 | C. | 有三句正确 | D. | 四句均正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
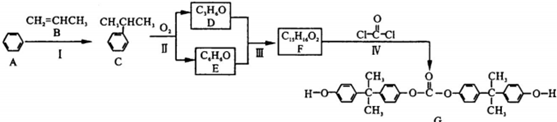
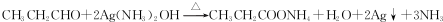 .
.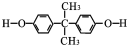 .
. 的反应合成航天用聚芳酯高分子,该化学反应方程式为
的反应合成航天用聚芳酯高分子,该化学反应方程式为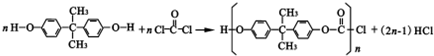 .
.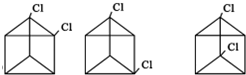 任意2种(任写两种).
任意2种(任写两种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com