
��14�֣�������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��
������������������������ȣ���ش��������⣺

(1)TԪ�ص����ӽṹʾ��ͼΪ__________��
(2)Ԫ�صķǽ�����(ԭ�ӵõ��ӵ�����)��Q ________W(�ǿ�ڡ������ڡ�)��
(3)W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________
(4)ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��_________________________________________________________�䷴Ӧ��ĵ���ʽΪ �����Ӱ뾶T3+__________R3-�������������������������
(5)R�ж�����������м���Է���������С����һ�������£�2 L�ļ�������0.5 L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ�������ֻ��һ�֣���ú������εĻ�ѧʽ��____________��
��1��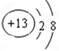 ��2������ ��3��S+2H2SO4(Ũ)
��2������ ��3��S+2H2SO4(Ũ)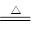 3SO2��+2H2O
3SO2��+2H2O
��4��2H2O2 2H2O+O2��
2H2O+O2�� 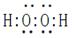 �� ��5��NaNO2
�� ��5��NaNO2
������������Ԫ�������ڱ��е�λ�ÿ�֪��T�ǵ������ڣ�����T��Al����Q��C��R��N��W��S��
��1��������ֻ��2�����Ӳ㣬���ӽṹʾ��ͼΪ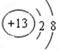 ��
��
��2�����������ǿ��̼��ģ�����̼�ķǽ�����������ķǽ����ԡ�
��3��Ũ������������ԣ��ڼ��ȵ��������ܺ͵�����Ӧ����SO2��ˮ������ʽΪS+2H2SO4(Ũ) 3SO2��+2H2O��
3SO2��+2H2O��
��4��ԭ��������R��1��Ԫ������Ԫ�أ���Ӧ���⻯����˫��ˮ��ˮ��˫��ˮ���ȶ����ֽ�����������ˮ������ʽΪ2H2O2 2H2O+O2��
��˫��ˮ�Ǻ��м��Լ��ͷǼ��Լ��Ĺ��ۻ��������ʽΪ
2H2O+O2��
��˫��ˮ�Ǻ��м��Լ��ͷǼ��Լ��Ĺ��ۻ��������ʽΪ ����������Ų���ͬ�����������뾶��ԭ���������������С���������Ӱ뾶T3+��R3-��
����������Ų���ͬ�����������뾶��ԭ���������������С���������Ӱ뾶T3+��R3-��
��5����Ԫ�ص�����������Է���������С����NO���ڷ�Ӧ�����֮������������ʵ���֮�ȣ����Ը��ݵ��ӵ�ʧ�غ��֪��NO�е�ԭ��ʧȥ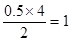 ����������������ļ�̬�ǣ���2��1������3�ۣ��������������������ơ�
����������������ļ�̬�ǣ���2��1������3�ۣ��������������������ơ�


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
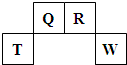 ��2009?������������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�
��2009?������������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ������ͼ��ʾ������Ԫ��T��������������������������ȣ���ش��������⣺
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ������ͼ��ʾ������Ԫ��T��������������������������ȣ���ش��������⣺

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?��خ��ģ�⣩������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ������ƶ���ȷ���ǣ�������
��2013?��خ��ģ�⣩������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ������ƶ���ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
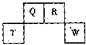 ��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com