
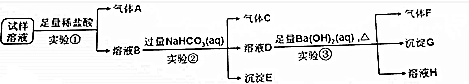
分析 (1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为二氧化碳或NO,由于盐酸过量且溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、NO3-、Cl-,且NO3-过量;根据离子共存可知一定不存在CO32-;
(2)硝酸根离子在酸性条件下具有强氧化性,能够将亚铁离子氧化成铁离子,同时生成NO气体,据此写出反应的离子方程式;
(3)实验①中盐酸足量,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应为:H++HCO3-=H2O+CO2↑;溶液B中还含有Fe3+,当氢离子反应完全后,铁离子与碳酸氢根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体;
当Fe3+-完全反应时,其离子浓度小于1×10-5mol•L-1,根据KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)列式计算;
(4)溶液D中加入氢氧化钡溶液加热后生成气体F、沉淀G和溶液H,气体F为氨气,由于碳酸氢钠过量,则沉淀G中一定含有碳酸钡,可能含有硫酸钡;
(5)由于碳酸氢钠过量,则生成的沉淀中不一定含有硫酸钡,需要通过对沉淀G进一步检验,可向沉淀G中加入稀硝酸,若沉淀部分溶解,则说明原溶液中一定含有了酸根离子.
解答 解:(1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为CO2或NO,由于盐酸过量且反应后溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、Cl-、NO3-,且NO3-过量;根据离子共存可知一定不存在CO32-,
故答案为:Fe2+、Cl-、NO3-;CO32-;
(2)实验①中亚铁离子与稀硝酸反应生成硝酸铁和一氧化氮和水,反应的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)实验①加入足量盐酸,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应的离子方程式为:H++HCO3-=H2O+CO2↑;溶液B中还含有Fe3+,氢离子反应完全后,铁离子与碳酸氢根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;当Fe3+-完全反应时,其离子浓度小于1×10-5mol•L-1,根据KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)可得:c(OH-)=$\root{3}{\frac{4×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=$\root{3}{4}$×10-11mol/L,溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$mol/L=$\frac{1×1{0}^{-3}}{\root{3}{4}}$,则此时溶液的pH=-lg$\frac{1×1{0}^{-3}}{\root{3}{4}}$=3+lg$\root{3}{4}$=3+$\frac{2}{3}$lg2=3.2,
故答案为:H++HCO3-=H2O+CO2↑;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;3.2;
(4)溶液D中加入足量Ba(OH)2溶液加热后生成气体F、沉淀G和溶液H,气体F为NH3,由于实验②中NaHCO3足量,则沉淀G中一定含有BaCO3,可能含有BaSO4,
故答案为:NH3;
(5)由于实验②中NaHCO3足量,则实验③的沉淀G中一定含有沉淀BaCO3,不能确定是否含有BaSO4,需要进行后续实验④,可向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-,
故答案为:向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-.
点评 本题考查了化学实验基本操作方法及其综合应用,题目难度中等,涉及离子推断、难溶物溶度积的计算、离子方程式书写、常见离子的检验等知识,明确常见化学实验基本操作方法为解答关键,试题知识点较多、综合性及其,充分考查了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
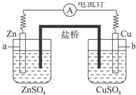
| A. | 有无盐桥不影响该原电池的工作 | |
| B. | 电池工作时,盐桥中K+会向Zn电极一侧移动 | |
| C. | 电池工作时,盐桥中Cl-会向Zn电极一侧移动 | |
| D. | 电池工作时,盐桥中的电子由Cu电极向Zn电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| B. | 向HCl和AlCl3的混合溶液中滴加溶液 | |
| C. | 向KAl(SO4)2溶液中滴加NaOH溶液 | |
| D. | 向NH4Cl和MgCl2的混合溶液中滴加NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I-可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50mL该溶液与过量Zn充分反应,生成0.56gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验操作 | 实验结论 |
| 1 | 将D溶液分别加入其他溶液中时,B、E中有气体产生 | D的化学式为NaHSO4 |
| 2 | 将B溶液和C溶液混合时,无明显现象,再向混合溶液中加入D溶液,仍无明显现象. | C的化学式NaClO E的化学式KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的蓝色石蕊试纸变红,该气体水溶液一定显酸性 | |
| C. | 某无色溶液中加硝酸钡溶液,再加入盐酸,沉淀不溶解,则溶液中一定有SO42- | |
| D. | 某无色溶液中加盐酸,产生无色气体,溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
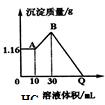 把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com