

 .
. 2NH3
2NH3分析 转化中各物质均是由短周期元素的单质及其化合物,化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2,据此解答.
解答 解:转化中各物质均是由短周期元素的单质及其化合物,化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2.
(1)H的化学式为:NH4Cl,故答案为:NH4Cl;
(2)用电子式表示CO2的形成过程: ,
,
故答案为: ;
;
(3)D和E反应的化学方程式:N2+3H2 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 2NH3;
2NH3;
(4)化合物G与I反应的离子方程式:2 H++CO32-═CO2+H2O,故答案为:2 H++CO32-═CO2+H2O;
(5)F和CO2的化学方程式:2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2.
点评 本题考查无机物推断,涉及Na、Cl、N元素单质化合物性质,物质的状态、焰色反应及转化中特殊反应等是推断突破口,侧重基础知识的巩固,难度中等,注意中学常见化学工业.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素代号[ | X | Y | Z | W |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | Z的氢化物的沸点比W的氢化物高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | A l、Mg分别与稀氢氧化钠溶液反应 | 比较铝、镁的金属性强弱 |
| B | 2mol/LNaOH溶液滴加到1mol/LCaCl2溶液中,产生白色沉淀 | 比较钠、钙的金属性强弱 |
| C | 用盐酸和碳酸钙反应制取的CO2直接通入Na2SiO3溶液中,溶液变浑浊 | 比较碳、硅的非金属性强弱 |
| D | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
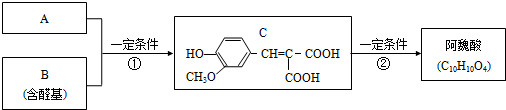
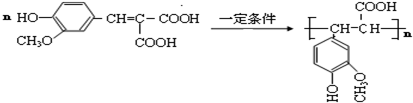 .
.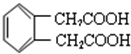 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com