
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干,得到晶体 | |
| D. | 称量时,称量物置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
分析 A.分液时,避免上下层液体混合;
B.蒸馏时,温度计测定馏分的温度;
C.蒸发时,出现大量固体时停止加热,利用余热加热;
D.称量时,遵循左物右码.
解答 解:A.分液时,避免上下层液体混合,则分液漏斗下层液体从下口放出,上层液体从上口倒出,故A正确;
B.蒸馏时,温度计测定馏分的温度,则使温度计水银球靠近蒸馏烧瓶支管口,故B正确;
C.蒸发时,出现大量固体时停止加热,利用余热加热,则不能将溶液蒸干,故C错误;
D.称量时,遵循左物右码,即称量物置于托盘天平的左盘,砝码放在托盘天平的右盘中,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属活泼性:Na<Mg<Al | B. | 碱性:NaOH>Al(OH)3>Mg(OH)2 | ||
| C. | 原子半径:Na<Mg<Al | D. | 与水反应的剧烈程度:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24372.86 kJ | B. | 21.44 kJ | C. | 600.20 kJ | D. | 21435.71 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥④ | B. | ⑧②⑥⑤ | C. | ③⑦⑥⑤ | D. | ④②⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
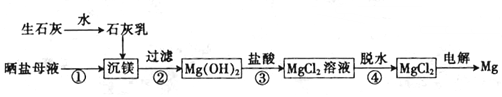
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com