
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
分析 A.Fe与氯气生成氯化铁,Fe与盐酸反应生成氯化亚铁;
B.Zn与稀硫酸反应生成氢气,Zn与浓硫酸反应生成二氧化硫,均为Zn失去电子,由电子守恒可知,生成氢气与二氧化硫的物质的量相同;
C.同主族从上到下原子半径增大,但碱金属的熔沸点降低;
D.非金属性越强,对应最高价氧化物对应水化物的酸性越强.
解答 解:A.因氯气、HCl的氧化性不同,则Fe与氯气生成氯化铁,Fe与盐酸反应生成氯化亚铁,故A错误;
B.Zn与稀硫酸反应生成氢气,Zn与浓硫酸反应生成二氧化硫,均为Zn失去电子,由电子守恒可知,生成氢气与二氧化硫的物质的量相同,则气体体积相同,故B正确;
C.同主族从上到下原子半径增大,但碱金属的熔沸点降低,则Li、Na、K的原子半价随原子序数的增加而增大,而熔沸点随原子序数的增加而减小,故C错误;
D.非金属性越强,对应最高价氧化物对应水化物的酸性越强,则C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强,故D错误;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及规律性知识为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 焚烧废旧塑料以防止“白色污染” | |
| B. | 明矾可用于净水,也可用于淡化海水 | |
| C. | 水瓶胆内部的水垢可用饱和食盐水清洗 | |
| D. | 氢氧燃料电池推广使用可实现碳零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ①④ | C. | ②③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是10电子微粒 | |
| B. | 氨气易液化,液氨可用作制冷剂 | |
| C. | 蘸有浓盐酸的玻璃棒遇氨气产生的白烟 | |
| D. | 氨气是电解质,NH3•H2O是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
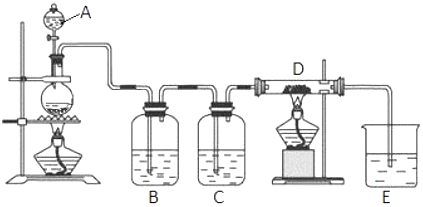
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com