
【题目】氧化还原反应在生产生活中有广泛的应用,回答下列问题。
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,下列反应中盐酸所体现的性质与该反应相同的是________
a.Zn+2HCl=ZnCl2+H2↑
b.KClO3+6HCl=KCl+3Cl2↑+3H2O
c.2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
d.2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应中氧化剂与还原剂的物质的量之比为______,若生成标准状况下3.36 L气体时转移的电子数为________。
(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。
【答案】bd 2:5 0.3NA ![]()
【解析】
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,在该反应中体现了盐酸的酸性和还原性;(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应离子方程式为:![]() ,过氧化氢为还原剂,高锰酸钾做氧化剂;由对应关系可知,生成5mol氧气转移了10mol电子;(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生了氧化还原反应。
,过氧化氢为还原剂,高锰酸钾做氧化剂;由对应关系可知,生成5mol氧气转移了10mol电子;(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生了氧化还原反应。
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,在该反应中体现了盐酸的酸性和还原性,故要选择的选项也要具有酸性和还原性,bd符合题意;
故答案为:bd;
(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应离子方程式为:![]() ,过氧化氢为还原剂,高锰酸钾做氧化剂,故氧化剂与还原剂的物质的量之比为:2:5,标况下下3.36 L气体的物质的量为:
,过氧化氢为还原剂,高锰酸钾做氧化剂,故氧化剂与还原剂的物质的量之比为:2:5,标况下下3.36 L气体的物质的量为:![]() ,生成5mol氧气转移了10mol电子,故转移的电子数为
,生成5mol氧气转移了10mol电子,故转移的电子数为![]() ;
;
故答案为:2:5;0.3NA;
(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生了氧化还原反应,离子方程式为:![]() ;
;
故答案为:![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是

A. 图①可表示用NaOH溶液滴定等浓度醋酸溶液,溶液导电性随NaOH的体积变化
B. 图②可表示25℃时,0.10 molL-1盐酸滴定20.00mL0.10 molL-1NaOH溶液的滴定曲线
C. 图③表示水溶液中c(H+)与c(OH-)的变化关系,则水的电离程度(![]() ):
):![]() ;水的离子积:KW(d)=KW(b)
;水的离子积:KW(d)=KW(b)
D. 图④表示合成氨N2(g)+3H2(g) ![]() 2NH3(g) △H<0的平衡常数与温度和压强的关系
2NH3(g) △H<0的平衡常数与温度和压强的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(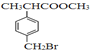 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
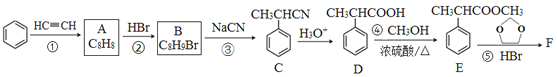
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。(无机试剂任选)
的合成路线_________________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。如图是模拟工业制备氢溴酸粗品并精制流程:
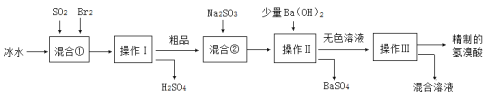
下列说法不正确的是
A.冰水的目的是降低反应温度,防止溴挥发,使反应更充分
B.混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr
C.操作Ⅱ和操作Ⅲ的名称分别为过滤和蒸馏
D.Na2SO3的作用是调节溶液的pH也可以用Na2CO3替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解治理水中硝酸盐的污染,在酸性条件下,电解的原理如图所示
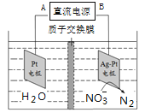
(1)A极为________极;
(2)阴极电极反应式为 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s、金刚石) + O2(g)=CO2(g) ΔH1=-395.4 kJmol-1,② C(s、石墨) + O2(g)=CO2(g) ΔH2=-393.5 kJmol-1 上述反应中的能量变化如图所示,下列说法正确的是

A.石墨和金刚石之间的转化是物理变化
B.图中 b 代表反应①的能量变化
C.C(s、金刚石) =C(s、石墨) ΔH= +1.9 kJmol-1
D.金刚石比石墨的热稳定性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将 H2O 和CO2 转化为 O2 和燃料(C3H8O)。下列说法正确的是( )
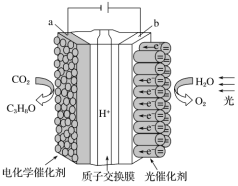
A.该装置将化学能转化为光能和电能
B.每生成 1 mol O2,有 44 g CO2 被还原
C.该装置工作时,H+从 b 极区向 a 极区迁移
D.a 电极的反应为 3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
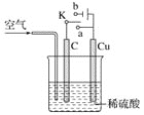
(1)甲同学认为,不通入空气,将 K 与_____(填“a”或“b”)连接,即可实现。则总反应的离子方程式为_____。
(2)乙同学认为在通入空气的同时,将开关 K 与_____连通,也可以实现,则电池总反应的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com