
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔、沸点 | |
| B. | 棉花、蚕丝的主要成分都是纤维素 | |
| C. | 常温常压下,0.1 mol D${\;}_{2}^{18}$O中含有的中子数、质子数、电子数均为NA | |
| D. | 乙烯和苯都能使溴水中的水层褪色,褪色的原因相同 |
分析 A.天然植物油常温下为不溶于水的液体,为混合物;
B.蚕丝的主要成分为蛋白质;
C.D${\;}_{2}^{18}$O中含有的中子数为(2-1)×2+(18-8)=12、质子数=电子数=1×2+8=10;
D.乙烯与溴水发生加成反应,苯与溴水不反应.
解答 解:A.天然植物油常温下为不溶于水的液体,为混合物,则没有恒定的熔、沸点,故A正确;
B.蚕丝的主要成分为蛋白质,而棉花的主要成分是纤维素,故B错误;
C.D${\;}_{2}^{18}$O中含有的中子数为(2-1)×2+(18-8)=12、质子数=电子数=1×2+8=10,则0.1 mol D${\;}_{2}^{18}$O中含有的质子数、电子数均为NA,而中子数为1.2NA,故C错误;
D.乙烯与溴水发生加成反应,苯与溴水不反应,则褪色原理不同,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物的组成、鉴别等,题目难度不大.


科目:高中化学 来源: 题型:解答题
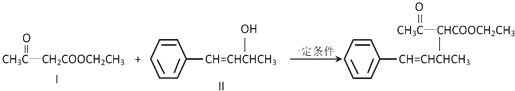
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里消耗n molA2,同时生成2n molAB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:2:3 | |
| D. | 单位时间里生成2n molAB的同时生成n molB2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
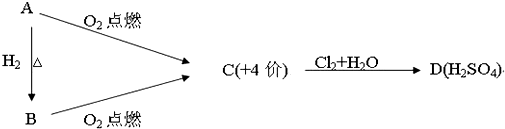
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2O5)=1.80×10-3 mol•L-1•min-1 | B. | v(N2O5)=1.08×10-2 mol•L-1•min-1 | ||
| C. | v(NO2)=1.80×10-3 mol•L-1•min-1 | D. | v(O2)=1.80×10-2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
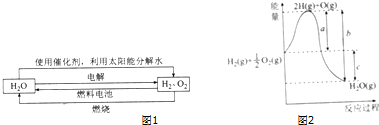 科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.
科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 植物油中加入含有酚酞的NaOH溶液,微热 | 红色变浅,且不再分层 | 油脂发生了水解反应 |
| B | 柠檬醛(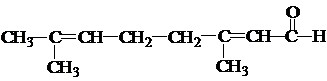 )中加入酸性高锰酸钾溶液 )中加入酸性高锰酸钾溶液 | 溶液褪色 | 柠檬醛分子中含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com