
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验。图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。

请回答有关问题:
(1)组装好装置后,关闭D,若装置的气密性良好,向外抽注射器活塞,C装置中有什么现象?
(2)反应开始前要向体系中通入气体A,为什么?
A可以是 (填序号) ①N2 ②O2 ③空气 ④CO2
(3)当完成装置A的实验目的后,关闭D,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是:
(4)反应一段时间后,将F中空气推入E中,证明生成了NO实验现象是:
(5)装置C的作用是:
科目:高中化学 来源: 题型:
下列常数表达式不正确的是:
A.2SO2(g)+O2(g)  2SO3(g)的化学平衡常数表达式为
2SO3(g)的化学平衡常数表达式为

B.NH3·H2O的电离平衡常数表达式为
C. 溶度积常数表达式为
溶度积常数表达式为
D. SO2(g)+ O2(g)  SO3(g)的化学平衡常数表达式为
SO3(g)的化学平衡常数表达式为

查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关实验的说法正确的是
A.向盛有碘水的分液漏斗中加入无水乙醇,振荡、静置,放出有机层后再蒸馏,提取碘水中的碘
B.取淀粉、稀硫酸共热后的溶液与新制Cu(OH)2反应,无红色沉淀生成,说明淀粉未水解
C.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
D.为除去粗盐中的Ca2+、Mg2+、SO42-,先后加入的试剂是H2O、Ba(OH)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是:( )
A.氯气通入水中,溶液呈酸性:Cl2+H2O 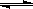 2H++Cl-+ClO-
2H++Cl-+ClO-
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.向明矾溶液中滴加Ba(OH)2溶液,达沉淀物质的量最大:
2Al3++3SO42-+3Ba2++6OH- = 2 Al(OH)3↓+3BaSO4↓
D.过量铁溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.硫粉在过量的氧气中燃烧可以生成SO3
C.将少量SO2通入BaCl2溶液能生成白色沉淀
D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(III)的化学方程式 。
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,反应(III)的离子方程式为 。
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(III)中氧化产物与还原产物的物质的量之比为 。0.1mol A与含0.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为 。
②25℃时,0.1mol·L-1 B、C溶液,pH较大的是 溶液(填溶质的化学式),写出B溶液中微粒浓度之间存在的等量关系 (写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,某密闭容器中发生反应:2HI(g)  H2(g)+I2(g) △H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
H2(g)+I2(g) △H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
A.15s内用H2表示的平均反应速率为v(H2)=0.002 mol·L-1·s-1
B.升高温度平衡逆向移动
C.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间为10s
D.减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
 ____
____ +____
+____ +____
+____ ____
____ +____
+____
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com