
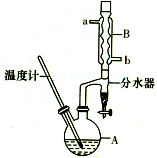
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
分析 (1)根据浓硫酸的稀释操作,进行迁移解答;正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3;
(2)采取逆流原理通入冷凝水进行充分冷却;
(3)用水可以溶解浓硫酸;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层;
(4)有机层中会残留NaOH及中和反应生成的盐Na2SO4,用水溶解除去;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,在分水器中会分层,密度小的在上层;
解答 解:(1)正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3,反应方程式为:2CH3CH2CH2CH2OH $?_{135℃}^{浓硫酸}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,因为浓硫酸的密度大,应将浓硫酸加到正丁醇中,防止发生迸溅,
故答案为:将浓H2SO4滴加到正丁醇中;
(2)采取逆流原理通入冷凝水,使冷凝管充分冷凝水,进行充分冷却,即从b口通入冷凝水,
故答案为:b;
(3)用水可以洗去混有的浓H2SO4;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层,应从分液漏斗的上口分离出,
故答案为:浓H2SO4;上;
(4)步骤④中最后一次水洗,可以洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,
故答案为:D;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,密度小于水,在分水器中会分层,正丁醇在上层,水在下层,
故答案为:正丁醇;水.
点评 本题考查有机物的制备实验,侧重考查物质分离提纯、对原理与操作的分析评价、产率计算等,难度中等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②⑤ | C. | ①②④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )就是其中的一种.
)就是其中的一种. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 65% | C. | 45% | D. | 37% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
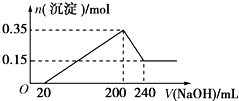 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com