
科目:高中化学 来源: 题型:选择题

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:6 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
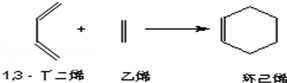
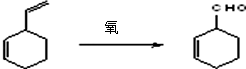
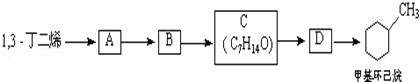
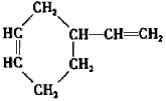 ;B
;B
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 | |
| C. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 | |
| D. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | N2 | NO | NO2 |
| B | S | SO2 | SO3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
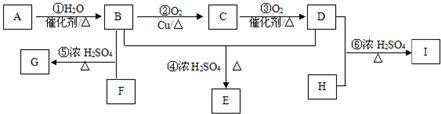
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com