
【题目】甲烷可制成燃料电池,其装置如图所示。下列说法正确的是( )

A. a极是正极
B. b极电极反应式为:O2-4e- +4H+=2H2O
C. 电解质溶液可能为碱性溶液
D. 若正极消耗的气体为2.24L(标况下),理论上电路中通过的电子的物质的量为0.4mol
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是____________,其含有的化学键类型___________
(3)最高价氧化物是两性氧化物的素是________;写出它的氧化物与盐酸反应的离子方程式_________________________________________
(4)写出元素③的氢化物的电子式______________
(5)写出④的单质与水反应的离子方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
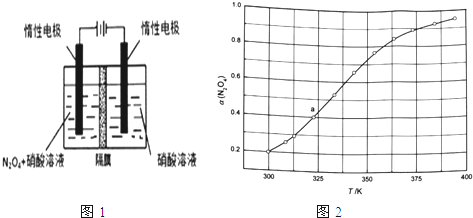
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | FeCl2溶液 | FeCl3溶液 | Cu | 过滤 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)K2FeO4 是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 + 3Cl2 + 10KOH![]() 2K2FeO4 + 6KCl + 8H2O在该反应中,还原剂是____________,当反应中有 1mol K2FeO4 生成时,转移电子的数目为___________。
2K2FeO4 + 6KCl + 8H2O在该反应中,还原剂是____________,当反应中有 1mol K2FeO4 生成时,转移电子的数目为___________。
(2)将铜片投入盛有稀硫酸的试管中无反应,当加入少量硝酸钾晶体后,铜片溶解。试用离子方程式表示其中的原因____________。
(3)新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_____。
(4)生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象。若知此反应为有氮气生成的置换反应,则化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验二氧化硫气体中是否混有二氧化碳气体,可采用的方法是
A.通过品红溶液
B.先通过氢氧化钠溶液,再通过澄清石灰水
C.先通过饱和碳酸氢钠溶液,再通过澄清石灰水
D.先通过酸性高锰酸钾溶液,再通过澄清石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com