
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

【答案】ABCD 饱和碳酸钠溶液 分液 分液漏斗 稀硫酸 蒸馏 b 酒精灯 冷凝管 牛角管 略高于 118 ℃
【解析】
分离出乙酸、乙醇、乙酸乙酯,利用其性质不同进行分离,如乙酸乙酯不溶于Na2CO3溶液,乙醇溶于碳酸钠溶液,乙酸与Na2CO3溶液发生反应,采用分液的方法分离出,然后利用乙醇易挥发,进行蒸馏等等,据此分析;
(1)A、从试管A中蒸出的气体为乙酸乙酯、乙酸、乙醇,振荡过程中乙酸、乙醇被碳酸钠溶液吸收,上层液体逐渐变薄,故A正确;
B、乙酸乙酯的密度小于水的密度,在上层,下层为碳酸钠溶液,碳酸钠溶液显碱性,滴入酚酞,溶液变红,试管A中蒸出的乙酸,与碳酸钠反应,产生CO2,溶液红色变浅或变为无色,故B正确;
C、根据B选项分析,故C正确;
D、乙酸乙酯有水果的香味,故D正确;
答案选ABCD;
(2)①碳酸钠溶液的作用是吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度使之析出,然后采用分液的方法进行分离,即A为乙酸乙酯,试剂1为饱和碳酸钠溶液;
②根据①的分析,操作1为分液,所用的主要仪器是分液漏斗;
③B中含有乙醇、乙酸钠、碳酸钠,利用乙醇易挥发的性质,采用蒸馏的方法得到乙醇,即操作2为蒸馏,E为乙醇,C为乙酸钠和碳酸钠,需要将乙酸钠转化成乙酸,然后蒸馏,得到乙酸,因此加入的酸,不易挥发,即试剂2最好是稀硫酸;
④根据③的分析,操作2为蒸馏;
⑤根据上述分析,操作3为蒸馏,温度计的水银球在支管口略向下,即b处;蒸馏过程中还需要的仪器有酒精灯、冷凝管、牛角管;乙酸的沸点为118℃,因此收集乙酸的适宜温度是略高于118℃。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B. CH2===CH2+HCl―→CH3CH2Cl
C. CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
D. 2CH3CH3+7O2![]() 4CO2+6H2O
4CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
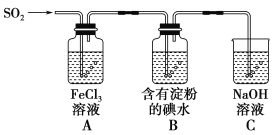
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年厦门大学王野教授课题组在合成气(主要成分CO和H2)催化转化制乙醇方面实施可控接力催化,按照:合成气→甲醇→乙酸→乙醇的方式,成功实现乙醇的高选择性合成。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+
O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+![]() O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+
O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+![]() O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
则工业上利用合成气制备甲醇的可逆反应热化学方程式为______________________;
(2)恒温恒容条件下,下列能说明合成气制甲醇的反应已达平衡状态的是_______;
A.单位时间内生成n mol CO的同时生成2n mol H2
B. v(H2)正= 2v(CH3OH)逆
C.容器内气体的密度保持不变
D.容器中气体的平均摩尔质量保持不变
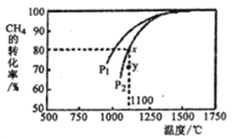
(3)利用天然气制取合成气的原理为: CO2(g)+CH4(g)= 2CO(g)+ 2H2(g),在密闭容器中通入物质的量浓度均为0.1 molL-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)_____v(逆) (填“大于”、“小于”或“等于”),求Y点对应温度下的该反应的平衡常数K=________ (计算结果保留两位有效数字)。
(4)以二氧化钛表面覆盖CuAlO4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250-300°C时,温度升高面乙酸的生成速率降低的原因是____;
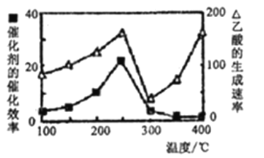
②为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
(5)一定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与b mol/ Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法正确的是 ( )
A.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.锌片和铜片用导线连接后插入CuSO4溶液中,铜片作负极
D.只有两种活泼性不同的金属才能构成原电池的两极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2CH2CH2CH3和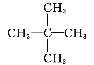 互为同分异构体
互为同分异构体
B.干冰和冰不是同一种物质
C.CH2 =CH2和CH2=CHCH3互为同系物
D.C4H10的一氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com